


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 6-9-2019
التاريخ: 25-12-2021
التاريخ: 27-11-2019
التاريخ: 27-10-2019
|
تتفاعل الكحولات مع هاليدات الهيدروجين وتتكون إثر ذلك هاليدات الألكيل وكما أشرنا سابقاً فإن هذا التفاعل له أهميته في تحضير الهاليدات الألكيلية أي يتم في هذا التفاعل استبدال مجموعة الهيدروكسيل بذرة الهالوجين. ويحفز هذا التفاعل بالحمض ولا يسير بمعدل ملموس مالم يوجد حمض قوي قد يكون هاليد الحمض المستخدم أو قد يكون حامضاً قوياً مثل حمض الكبريتيك.
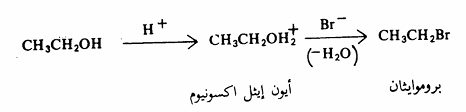
ولايتم استبدال مجموعة الهيدروكسيل في الكحول نفسه لأن مثل هذا الاستبدال يتطلب استبدال أيون الهيدروكسيد وهو قاعدة قوية حيث أن القواعد الضعيفة في العادة هي. هي التي تمثل مجموعات سهلة الإزاحة (مغادرة جيدة). وترتيب فعالية الكحولات تجاه هاليدات الهيدروجين هو:
Benzyl,allyl >30 >20 > 10 alcohol
الكحولات الثالثية أقوى من الكحولات الثانوية وهذه بدورها أقوى من الكحولات الأولية فالكحول الثالثي يتفاعل مع حمض الهيدروكلوريك المخفف dilute HCl وعند درجة حرارة الغرفة إذ يتكون كلوريد الألكيل المطابق.
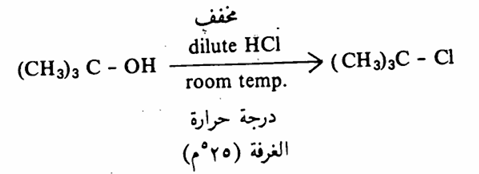
أما كلوريد الألكيل الناشيء من الكحول الأولي فلا يتم إلا بالتسخين ومع حمض الهيدروكلوريك المركز conc. HCI.
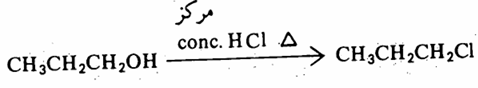
ففي الكحول الأولي يحدث استبدال ثنائي الجزيئية SN2 من الجهة الخلفية لذرة الكربون الأولية أي يحدث تغير في الكيمياء الفراغية لها وهو انقلاب
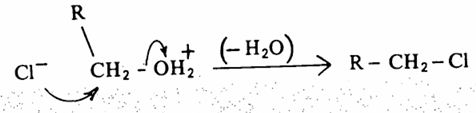
ومن ناحية أخرى فإن أيون الأكسونيوم الناتج من الكحول الثالثي يميل للتأين (تفاعل أحادي الجزيئية للحمض المرافق حيث ينشأ أيون الكربونيوم الثالثي الأكثر ثباتاً من أيون الكربونيوم الأولية والثانوية. وفور تكون أيون الكربونيوم الثالثي ذي الخاصية الالكتروفيلية القوية فإنه يتفاعل مع الكاشف النيكلوفيلي وهو أيون الكلوريد.
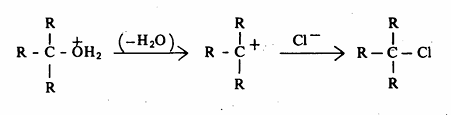
أما الكحول الثانوي فيقوم بهذا التفاعل ولكن تحت ظروف وسطية بين تلك الظروف التي يتم عندها تفاعل الكحولات الأولية وبين تلك الظروف التي يتم عندها تفاعلات الكحولات الثالثية ولكنه يخضع في الغالب لميكانية SN1. هناك كشف وصفي يدعى كشف لوكس يستخدم في المختبر على نطاق واسع لتمييز الكحولات الذائبة في الماء إذا ما كانت أولية أو ثانوية أو ثالثية. ويستخدم هذا الكشف )كاشف لوكس عبارة عن حمض الهيدروكلوريك المركز مذاباً فيه ZnCl2. وفي العادة يجري التفاعل عند درجة حرارة الغرفة) للتمييز بين الكحولات وذلك وفقاً للسرعة التي يتم بها تكوين كلوريد الألكيل. فالكحولات الثالثية تتفاعل في الحال مع حمض الهيدروكلوريك المركز حيث يتعكر المحلول في مدة وجيزة، وهذا التعكر يدل على تكوين كلوريد الألكيل المطابق. هذا ومع مرور الوقت فقد ينفصل كلوريد الألكيل على هيئة طبقة زيت أما في حالة الكحول الثانوي فيتأخر التعكر يظهر) كلوريد الألكيل مؤخراً على هيئة طبقة لا تمتزج مع الكاشف) يظهر في زمن من 5 إلى 10 دقائق وذلك في درجة حرارة الغرفة. أما الكحولات الأولية فتبقى ذائبة في الكاشف على هيئة ملح أكسونيوم وعليه لا تنفصل طبقة في المحلول. وإذا كانت مجموعة الألكيل ثالثية أو مجموعة تميل لأن تعطي أيون كربونيوم يتصف بالثبات مثل أيون كربونيوم البنزيل أو الألليل، فهذه الأيونات كواشف الكتروفيلية قوية تتفاعل مع أيون الكلوريد في الحال ويتعكر المحلول أو تنفصل طبقة هاليد الألكيل (غير ذواب في الماء).



|
|
|
|
لصحة القلب والأمعاء.. 8 أطعمة لا غنى عنها
|
|
|
|
|
|
|
حل سحري لخلايا البيروفسكايت الشمسية.. يرفع كفاءتها إلى 26%
|
|
|
|
|
|
|
قسم الحزام الأخضر الجنوبي ينظّم حفلاً بذكرى ولادة الإمام علي (عليه السلام)
|
|
|