


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 22-11-2019
التاريخ: 28-11-2019
التاريخ: 28-7-2019
التاريخ: 2023-08-05
|
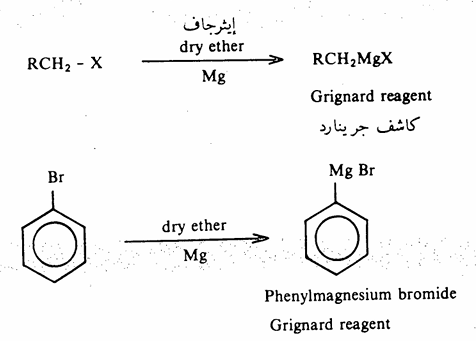
-1تكوين كاشف جرينارد Grignard Reagent تتفاعل الهاليدات العضوية سواء الأليفاتية أو الأروماتية مع المغنسيوم في وجود الايثر الجاف لتعطي كاشف جرينارد إلا أن الهاليدات الأليفاتية تتفاعل بشكل أنشط المغنسيوم. ولمركبات جرينارد هذه أهمية كبيرة في تحضير العديد من المركبات العضوية وقد سبق وأن أوضحنا استخدامها في تحضير الألكانات، وسيتضح لنا المزيد من ذلك في الفصول القادمة إذ أنها تشغل حيزاً كبيراً في المختبر لتحضير العديد من المركبات العضوية مثل الكحولات والحموض الكربوكسيلية.
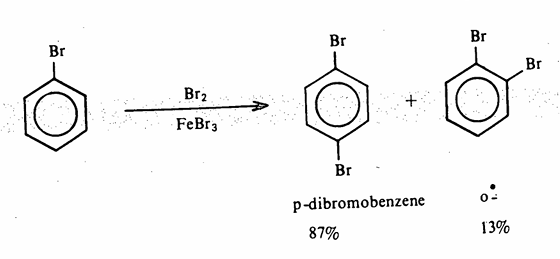
2-الإستبدال الأروماتي الالكتروفيلي :
هذا النوع من التفاعلات يخص الهاليدات الأروماتية وقد سبق وأن
أشرنا إلى هذا النوع من التفاعلات وكيف أن الهالوجين عندما يكون مرتبطاً بالحلقة الأروماتية يثبط تفاعل الإستبدال الالكتروفيلي ويوجه المجموعة الالكتروفيلية إلى المواضع أرثو وبارا على الحلقة
الأروماتية.
3-الإستبدال النيكلوفيلي Nucleophilic Substitution : يعتبر أيون الهاليد قاعدة ضعيفة (أي أيون مستقر) وبالتالي فإن القواعد الأكثر قوة (أقل استقراراً، أو بمعنى آخر أكثر نشاطاً) يمكن أن تحل محل أيون الهاليد هذه القواعد تحمل زوجاً الكترونياً حراً (غير مشترك) وتبحث عن موقع موجب تسمى تلك القواعد الغنية بالإلكترونات بالكواشف النيكليوفيلية Nucleophilic reagents أي الكواشف المحبة للنواة، وبالتالي فإن هذه التفاعلات تسمى استبدال (إحلال) نيكلوفيلي حيث تحل تلك القواعد (النيكلوفيلات) محل أيون الهاليد.

ويمكن ترتيب نشاط الهاليدات الألكيلية تجاه الاستبدال النيكلوفيلي على النحو التالي : R-I>R-Br>R-Cl >R-F
وهذا يعود إلى قوة الرابطة بين الهالوجين والكربون وعلى مدى ثبات أيون الهاليد الناتج (المجموعة (المزاحة حيث تأخذ الترتيب التالي :
I- > Br- > Cl- > F-
اقل ثبات أكثر ثبات
(اقوى قاعدية) (أضعف قاعدية )
هذا وتتفاعل الهاليدات الألكيلية مع عدد كبير من الكواشف النيكليوفيلية لتعطي نواتج مختلفة ذات أهمية كبيرة. ويمكن تقسيم العوامل النيكليوفيلية إلى نوعين :
(أ) نيكلوفيلات تحمل شحنة سالبة على هيئة أيون: مثل أيون الهيدروكسيد 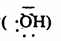 وأيون الألكوكسيد
وأيون الألكوكسيد وأيون السيانيد
وأيون السيانيد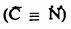
وأيون الهاليد ( ) وغيرها.
) وغيرها.
(ب) نيكلوفيلات متعادلة ولكن تحمل زوجاً الكترونياً حراً: مثل الماء (H2O) والأمونيا (NH3) والكحول (ROH) وغيرها. وفيما يلي أمثلة على تفاعلات الإستبدال النيكليوفيلية للهاليدات الألكيلية والتي سوف ندرس المزيد منها في الفصول القادمة.
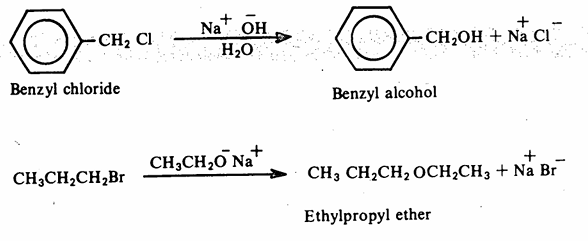
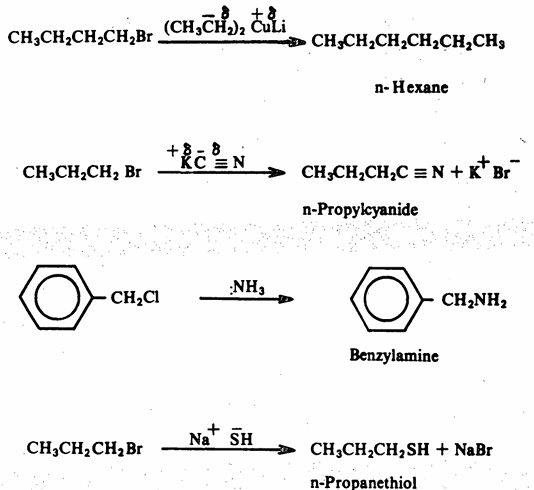
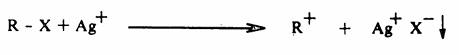
يتم الإستبدال النيكليوفيلي على مجموعات فعالة أخرى بالإضافة إلى الهاليدات الألكيلية مثل الكحولات وغيرها لذلك سندرس هذا النوع التفاعلات في نهاية هذا الفصل بشيء من التفصيل . وتجدر الإشارة إلى أن الإستبدال النيكليوفيلي يتم بصعوبة كبيرة جداً في حالة الهاليدات الأروماتية وكذلك هاليدات الفاينل Vinyl halides (والتي فيها ذرة الهالوجين مرتبطة مباشرة بذرة كربون الرابطة المضاعفة). فمثلاً نجد أنه يمكن التعرف على الهاليدات الألكيلية بترسب هاليد الفضة عديم الذوبان وذلك عند تدفئة هذه الهاليدات مع كاشف نترات الفضة الكحولية. ولكن لايتم هذا التفاعل مع الهاليدات الأروماتية أو مع هاليدات الفاينل.
ويرجع السبب إلى أن الرابطة بين الهالوجين والكربون : الهاليدات الأروماتية أو هاليدات الفاينل أقوى منها في حالة الهاليدات الألكيلية. يرجع سبب قوة الرابطة إلى إمكانية حدوث تأرجح بين أزواج الالكترونات الحرة في الهالوجين والكترونات باى في الحلقة الأروماتية أو الرابطة المضاعفة هذا التأرجح يجعل الرابطة بين الهالوجين والكربون في تلك الهاليدات تأخذ صفة الرابطة المضاعفة والتي هي أقوى من الرابطة الأحادية. كما أن الهالوجين في تلك الهاليدات مرتبط بذرة كربون ذات الهجين sp2 وهذا يعني أن الرابطة بينهما أقصر وأقوى مما هو عليه الحال في هاليدات الألكيل حيث أن الهالوجين في الأخيرة مرتبط بذرة كربون ذات هجين sp3

لذلك نجد انه لكي يتفاعل كلوروبنزين مع هيدروكسيد الصوديوم يجب ان نرفع درجة حرارة التفاعل الى 350م تحت ضغط عالي جدا (4500 رطل /انش2 )
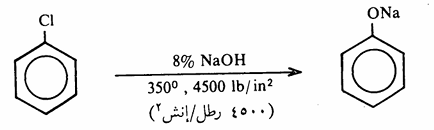
وكذلك يتفاعل كلوروبنزين مع الأمونيا ولكن تحت ظروف قاسية - ليعطي الأنيلين.
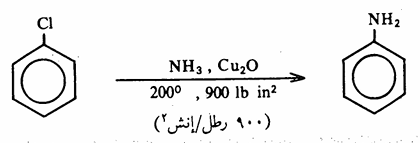
وفي حالة وجود مجموعات ساحبة للإلكترونات على الحلقة الأروماتية فإن ذلك ينشط تلك الهاليدات تجاه الإستبدال النيكليوفيلي ويمكن فهم ذلك من دراسة ميكانية التفاعل. تتم ميكانية التفاعل في خطوتين، الأولى هجوم نيكليوفيلي على الحلقة لتكوين أيون كربانيون ( أنيون الكربون) ، والثانية انتزاع أيون الهاليد ليعطي الناتج الخطوة الأولى هي البطيئة وبالتالي هي المحددة لسرعة التفاعل.
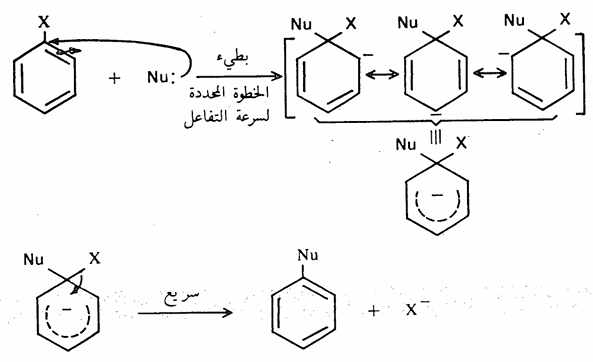
لذلك فإن وجود مجموعات ساحبة للإلكترونات (مثل مجموعة (NO2)، وبالذات في موضعي أرثو وبارا، سوف تزيد من ثبات الحالة الانتقالية المؤدية إلى أيون الكربانيون وهذا يؤدي إلى تنشيط التفاعل. لذلك نجد أن التفاعلين السابقين يحدثان تحت ظروف أسهل في حالة وجود مجموعات النيترو على المواقع أرثو وبارا على الحلقة الأروماتية كما يتضح من المعادلات الآتية :

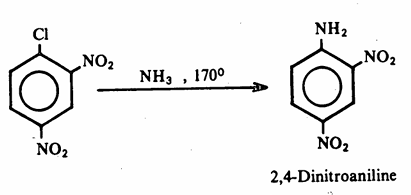
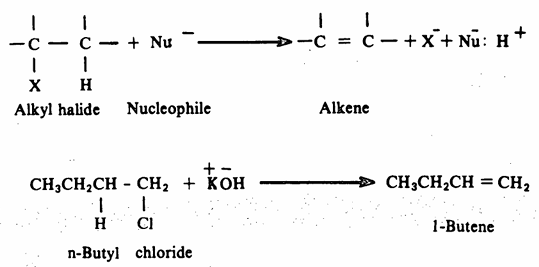
4- تفاعلات الانتزاع Elimination :
تخضع الهاليدات الألكيلية لتفاعلات الانتزاع. حيث يتم انتزاع الهالوجين والبروتون الذي يرتبط بذرة الكربون المجاورة لذرة الكربون التي يرتبط بها الهالوجين مما يؤدي إلى الحصول على الألكين. تحدث تفاعلات الانتزاع وكذلك تفاعلات الإستبدال النيكليوفيلي على الهاليدات الألكيلية بواسطة كواشف قاعدية لذلك فإنه من المتوقع حصول منافسة بين تفاعلات الإستبدال والانتزاع تعتمد على عدة عوامل مثل نوع الكاشف القاعدي والتركيب البنائي لهاليد الألكيل وغيرها كما سنرى فيما بعد. كما وتحدث تفاعلات الانتزاع هذه، مثلها مثل تفاعلات الإستبدال النيكليوفيلي، مع مجموعات فعالة أخرى مثل الكحولات وغيرها كما سيتضح لنا في نهاية هذا الفصل حيث سنقوم بدراستها.



|
|
|
|
دراسة تحدد أفضل 4 وجبات صحية.. وأخطرها
|
|
|
|
|
|
|
قسم الشؤون الفكرية يصدر كتاب الفلسفة الغربية برؤية الشيخ مرتضى مطهري
|
|
|