


 الفيزياء الكلاسيكية
الفيزياء الكلاسيكية
 الكهربائية والمغناطيسية
الكهربائية والمغناطيسية
 علم البصريات
علم البصريات
 الفيزياء الحديثة
الفيزياء الحديثة
 النظرية النسبية
النظرية النسبية
 الفيزياء النووية
الفيزياء النووية
 فيزياء الحالة الصلبة
فيزياء الحالة الصلبة
 الليزر
الليزر
 علم الفلك
علم الفلك
 المجموعة الشمسية
المجموعة الشمسية
 الطاقة البديلة
الطاقة البديلة
 الفيزياء والعلوم الأخرى
الفيزياء والعلوم الأخرى
 مواضيع عامة في الفيزياء
مواضيع عامة في الفيزياء|
أقرأ أيضاً
التاريخ: 6-2-2022
التاريخ: 31-12-2020
التاريخ: 2023-06-14
التاريخ: 1-2-2022
|
لا يتخلى علماء الكيمياء الفيزيائية عن دراسة الذّرَّة عند هذا المستوى ويسلمون الراية إلى علماء الكيمياء غير العضوية. وإنما يواصلون الاهتمام بالخواص المتنوعة للذرات التي تنشأ من بنيتها الإلكترونية وتلعب دورًا في التحكم بالشخصية الكيميائية الخاصة بالعناصر.
ربما أهم خاصية للذرة وذات صلة بالمركبات التي يمكنها تكوينها هي حجمها، لا سيما «نصف قطرها». فعلى الرغم من أن الذرة تملك سحابة ضبابية من الإلكترونات تحيط بنواتها، تتناقص كثافة السحابة على نحو سريع جدًّا من عند الحافة، ومن ثم فإن الحديث عن نصف قطر الذرة ليس مضللا للغاية. فمن الناحية العملية، يتحدد نصف قطر الذرة معمليًّا من خلال قياس المسافة بين ذرتين متحدتين في جزيء أو مادة صلبة، وتقسيم تلك المسافة على كل ذرة بطريقة معينة. ونجد أن أنماط نصف القطر الذري ترتبط بالمكان الذي يشغله العنصر في الجدول الدوري. وبالتالي، عند الاتجاه من يسار الجدول إلى يمينه، تصير الذرات أصغر حجمًا فعلى الرغم من تزايد عدد الإلكترونات على نحو تدريجي، تزداد شحنة النواة أيضًا، وتجتذب السحب الإلكترونية إليها. ومع الاتجاه إلى أسفل أي مجموعة، تصير الذرات أكبر حجمًا لأن أغلفة خارجية جديدة تظهر في الدورات المتعاقبة (كما يحدث عند الاتجاه من الليثيوم إلى الصوديوم) وكل طبقة جديدة من السحابة تجعل الذرة أكبر حجمًا (انظر شكل 1–2).
وتأتي «طاقة التأين» في المرتبة الثانية من حيث الأهمية، وهي الطاقة اللازمة لنزع إلكترون واحد أو أكثر من الذرة. كما سنرى تحدد القدرة على انتزاع الإلكترونات من الذرة على نحو جزئي أو كلي أنواع الرابطة الكيميائية التي تستطيع الذَّرَّة أن تكونها، ومن ثَم تلعب دورًا كبيرًا في تحديد خواصها. وتتتبع طاقة التأيُّن بشكل أو آخر أنماط نصف القطر الذري ولكن بصورة معاكسة لأنه كلما اقترب الإلكترون من النواة الموجبة الشحنة، كان من الصعب انتزاعه. وبالتالي تزداد طاقة التأيُّن عند الاتجاه من يسار الجدول الدوري إلى يمينه حيث تكون الذرات أصغر حجمًا. وبالاتجاه إلى أسفل أي مجموعة، تقل طاقة التأيُّن لأن الإلكترون الخارجي (ذلك الذي يسهل انتزاعه) يبتعد عن النواة على نحو متزايد تدريجيا. وبإمكان العناصر الموجودة يسار الجدول الدوري أن تفقد إلكترونًا أو أكثر بسهولة معقولة : كما سنرى في الفصل الرابع، تتمثل إحدى النتائج في أن هذه العناصر تعد فلزات. أما العناصر الموجودة على يمين الجدول فتأبى بشدة أن تفقد الإلكترونات ومن ثُم فهي ليست فلزات (إنها «لا فلزات»).
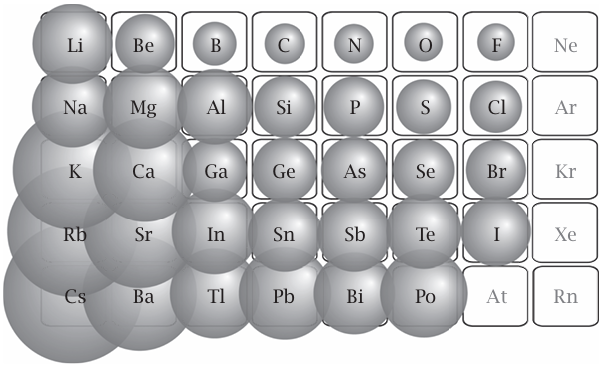
شكل 2–1: تغير نصف القطر الذري عبر الجدول الدوري. يتناقص نصف قطر الذرات على نحو نموذجي من يسار الجدول الدوري إلى يمينه ويزداد من أعلى إلى أسفل أي مجموعة. يوضح هذا الشكل عناصر «المجموعات الأساسية» (لا العناصر الانتقالية).
ويأتي «الميل الإلكتروني» في المرتبة الثالثة من حيث الأهمية، وهو الطاقة المنبعثة عندما يُضاف إلكترون إلى ذَرَّة. ويكون الميل الإلكتروني عند أقصى حد في العناصر الموجودة يمين الجدول الدوري (بالقرب من عنصر الفلور؛ تجاهل الحالة الخاصة للغازات النبيلة). ويمكن أن تسع هذه الذرات الصغيرة نسبيًّا إلكتروناً في طبقة السحابة الخارجية الممتلئة بشكل غير كامل وبمجرد أن يصل إلى هناك يستطيع التفاعل بقوة وعلى نحو موات مع النواة القريبة.
وتظهر أهمية طاقة التأين والميل الإلكتروني عندما نتأمل «الأيونات» التي من المرجح أن تكونها الذرات. و«الأيون» هو ذرة ذات شحنة كهربائية. وتأتي هذا الشحنة إما لأن الذرة المتعادلة الشحنة فقدت إلكتروناً أو أكثر، وفي هذه الحالة تصبح «كاتيونا» cation موجب الشحنة وإما لأنها اكتسبت إلكتروناً أو أكثر وصارت «أنيونا» anion سالب الشحنة. وسميت هذه الأيونات بـ «الكاتيونات» و«الأنيونات من جانب علماء الكيمياء الفيزيائية الدارسين للموصلية الكهربائية للأيونات في المحاليل، مثل الملح المذاب في الماء، والذين لاحظوا أن إحدى فئات الأيونات تحركت إلى «أعلى» تدرج فرق الجهد الكهربائي بينما تحركت فئات أخرى «لأسفله» (والمقابل الإنجليزي لكلمة «أيون» ion مشتق من الكلمة اليونانية التي تعني المسافر، وan و cat هما سابقتان تعنيان « لأعلى» و «لأسفل»، على التوالي).
ومن المرجح أن تفقد العناصر الموجودة على يسار الجدول الدوري، ذات طاقات التأين المنخفضة، إلكترونات وتكون كاتيونات؛ أما العناصر الموجودة على يمين الجدول الدوري، ذات المستوى العالي من الميل الإلكتروني، فمن المرجح أن تكتسب إلكترونات وتكون أنيونات. يقودنا هذا الفارق إلى لب موضوع استكشفه علماء الكيمياء الفيزيائية وشرحوه؛ ألا وهو طبيعة الرابطة الكيميائية.



|
|
|
|
دراسة يابانية لتقليل مخاطر أمراض المواليد منخفضي الوزن
|
|
|
|
|
|
|
اكتشاف أكبر مرجان في العالم قبالة سواحل جزر سليمان
|
|
|
|
|
|
|
اتحاد كليات الطب الملكية البريطانية يشيد بالمستوى العلمي لطلبة جامعة العميد وبيئتها التعليمية
|
|
|