


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2024-02-01
التاريخ: 27-11-2015
التاريخ: 2024-02-11
التاريخ: 27-11-2015
|
إن الله - سبحانه وتعالى - خلق هذا الكون من العدم. والمادة التي نتعامل معها تتكون من عناصر تتألف من وحدات متشابهة وهي الذرات وكل ذرة تتكون من عدد محدد من الإلكترونات والبروتونات وبها أيضاً النيوترونات.
يتبين من هذا أن الذرة خلقها الله تعالى من مكونات دقيقة هي البروتونات والنيوترونات وجسيمات أخرى عديدة ما زال العلم يكتشف بعضها.
والإلكترون هو جسيم سالب الشحنة وكتلته أقل بكثير من البروتون الموجب الشحنة. وتكون الذرة متعادلة إذا ما كان عدد الإلكترونات مساويا لعدد البروتونات. وتتحرك الإلكترونات في مستويات طاقة حول نواة الذرة، وكلما كان الإلكترون قريبا من النواة كانت حالته أكثر ثباتًا، ويسمى هذا بالإلكترون الأكثر موجبية. ويكون هذا الإلكترون أكثر ثباتًا من الإلكترون البعيد عن النواة الذي يتسم بالأكثر سالبية. وعادة يحاول الإلكترون الأكثر سالبية الانتقال إلى الحالة الأكثر ثباتًا بأن يكون قريبًا من النواة. وعلى هذا الأساس كلما سنحت الفرصة لهذا الإكترون ليصبح أكثر موجبية فإنه يقوم بها وذلك عن طريق فقد كمية محددة من الطاقة ومن ثم النزول إلى مستويات منخفضة الطاقة تكون قريبة من نواة الذرة. وهذا هو المبدأ الذي تقوم عليه الخلية الجلفانية. وإذا ما أردنا أن نجعل الإلكترون في ذرة أحد المعادن أكثر سالبية فإننا نقوم بتوصيل قطعة ذلك من المعدن بالقطب الموجب لمصدر كهربائي خارجي، حيث تترك هذه الإلكترونات مستوياتها ذات الطاقة المنخفضة، وتنتقل إلى مستويات عالية الطاقة يمكنها بعدها أن تنتقل إلى ذرات في عناصر أخرى تحتوي على مدارات منخفضة الطاقة وخالية من
الإلكترونات. وهذا هو المبدأ الذي تقوم عليه الخلية الإلكتروليتية. وهذان المبدآن هما أساس طرق التحليل الكهروكيميائي.
تعتمد طرق التحليل الكهروكيميائي على ظاهرة الانتقال الإلكتروني (Electron Transfer)، وتحصل هذه الظاهرة عند اقتراب ذرتين تتميز إحداهما ، ولتكن ذرة A بوجود إلكترون أو أكثر في مستوى طاقة عال، بينما يوجد في الذرة الثانية B مستوى طاقة منخفض لا يحتوي على إلكترونات. فإذا ما اقتربت الذرتان من بعضهما فإن الإلكترون الموجود في المدار الأعلى في الذرة A ينتقل إلى المدار الفارغ والمنخفض الطاقة في الذرة ،B ، إذ إن الإلكترونات دائماً تحبذ أن تكون في مستوى الطاقة الأكثر ثباتاً. ويتحقق هذا الوضع بانتقال هذا الإلكترون من مدار عالي الطاقة إلى آخر ذي طاقة أقل وتسمى هذه العملية الانتقال الإلكتروني.
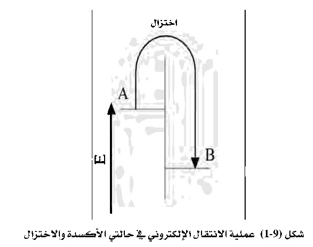
وتعرف ظاهرة الانتقال الإلكتروني بعملية التأكسد والاختزال، فتكون الذرة A في هذه الحالة قد تأكسدت وأصبح عدد الأكسدة لها + 1 ، والذرة B حصلت على إلكترون وصار لها عدد الأكسدة -1. ويقال أيضاً للذرة A أنها عامل مختزل، وللذرة B بأنها عامل مؤكسد.



|
|
|
|
"عادة ليلية" قد تكون المفتاح للوقاية من الخرف
|
|
|
|
|
|
|
ممتص الصدمات: طريقة عمله وأهميته وأبرز علامات تلفه
|
|
|
|
|
|
|
ضمن أسبوع الإرشاد النفسي.. جامعة العميد تُقيم أنشطةً ثقافية وتطويرية لطلبتها
|
|
|