


 الفيزياء الكلاسيكية
الفيزياء الكلاسيكية
 الكهربائية والمغناطيسية
الكهربائية والمغناطيسية
 علم البصريات
علم البصريات
 الفيزياء الحديثة
الفيزياء الحديثة
 النظرية النسبية
النظرية النسبية
 الفيزياء النووية
الفيزياء النووية
 فيزياء الحالة الصلبة
فيزياء الحالة الصلبة
 الليزر
الليزر
 علم الفلك
علم الفلك
 المجموعة الشمسية
المجموعة الشمسية
 الطاقة البديلة
الطاقة البديلة
 الفيزياء والعلوم الأخرى
الفيزياء والعلوم الأخرى
 مواضيع عامة في الفيزياء
مواضيع عامة في الفيزياء|
أقرأ أيضاً
التاريخ: 17-9-2020
التاريخ: 2023-06-22
التاريخ: 10-2-2022
التاريخ: 2024-03-26
|
مستويات طاقة الهيدروجين
ان ذرة الهيدروجين لابد أن تكون لها حالات مستقرة تكون فيها الذرة ثابتة متزنة. وقد توصلت النظرية التي ألممنا بها إلى أن تلك الحالات المستقرة تتكون من مدارات دائرية ذات أنصاف أقطار تعطى، في حالة الهيدروجين، بالعلاقة:
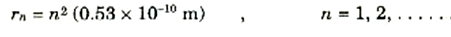
ويوضح الشكل 1)) المدارات القليلة المستقرة الأولى، وسنتعرف الآن على الطاقة التي للذرة في لك من هذه الحالات.
لابد لكل من الحالات المستقرة التي وجدناها من طاقة مميزة لها. وطاقة الذرة تتكون من شقين، أحدهما هو طاقة حركة الإلكترون عندما يتحرك في مداره، وتعطى هذه الطاقة ــ بالنسبة للمدار رقم n بالعلاقة،
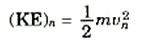
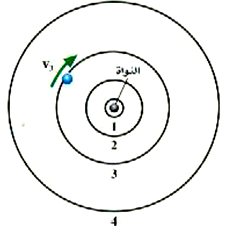
الشكل 1)): يقوم الإلكترون بالدوران حول النواة في سلسلة من المدارات المستقرة التي تحقق شرط الرنين، ولن تتاح له أية مدارات أخرى مستقرة وحجم النواة في الشكل مبالغ فيه إلى حد كبير.
حيث أمكن لنا إهمال ظواهر النسبية؛ تصبح هذه العلاقة
(1) 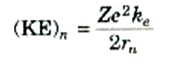
ويمتلك الإلكترون بالإضافة إلى طاقة حركته، طاقة وضع كهربية سالبة. ويرجع السبب في كونها سالبة إلى أننا نعرف طاقة وضع شحنتين على أنها تساوي الصفر عندما تكون المسافة بينهما لا نهائية. وكلما اقترب الإلكترون من النواة، فإنه "ينحدر" بالنسبة لطاقة الوضع لأن النواة تجذبه، أي أنه يتحرك نحو طاقات وضع أقل من الصفر أي سالبة. وطاقة وضع إلكترون يقع على مسافة ra من شحنة موجبةZe هي
(2) 
فإذا أضفناها إلى طاقة حركة الإلكترون في المدار رقم n(المعادلة (1)) فإننا نحصل على الطاقة الكلية للذرة في الحالة المستقرة رقم n:
(3) 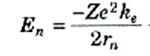
يلاحظ أن طاقة الذرة سالبة وتصبح أكثر سالبية كلما انخفضت قيمة rn(وبعبارة اخرى: كلما اقترب الإلكترون من النواة).
يمكننا الآن كتابة المعادلة (3) على طورة أكثر ملاءمة للتعويض عن قيمة rn:
(4) 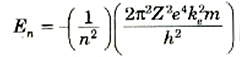
وإذا عوضنا عن قيم الثوابت الواردة في هذه المعادلة فإننا نحصل على Z = 1 على:
(5) 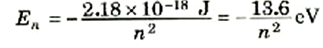
ومعنى الطاقة الكلية السالبة هو أن الإلكترون مرتبط بالنواة، ولو أنه اكتسب ما يكفى من الطاقة من أحد المصادر الخارجية (بالتصادم مثلاً، حتى تصبح طاقته الكلية موجية، فإن لن يصبح مرتبطاً: بل سيصير حراً.
ولنتذكر أن كل قيمة من قيم n تناظر حالة مستقرة واحدة للذرة. فالحالة n =1، في إطار النموذج شبه الكلاسيكي، تناظر إلكتروناً يدور في أصغر مدار ممكن له r1 وتسمى طاقة الذرة في هذه الحالة، الحالة الأرضية وهي تساوي E1 = -13.6 eV، ولما كانت النظم إذا خلى بينها وبين أية مؤثرات خارجية تميل إلى الهبوط إلى أدنى طاقة ممكنة، فإن ذرات الهيدروجين توجد عادة في الحالة n = 1. وعندما n = 2، وهي تناظر حالة الطاقة الأعلى التالية، فإن نصف قطر المدار يصبح 4πr، وعندئذ تصبح طاقة الذرة هي:

يلاحظ هنا أن E2 أكبر من E1، بمعنى ان طاقة الذرة في الحالة 2 أعلى من طاقتها في الحالة 1. وسنكتب على سبيل المثال الإيجاز:
(6) 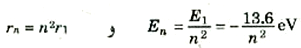
وكما هو واضح فإن طاقات الإلكترون في الذرة مكماة مثلما كانت حالة الجسيم المحصور داخل انبوبة.
من المناسب دائماً أن نمثل طاقات النظام المكماة (كالذرات مثلاً) على هيئة ما يسمى الرسم البياني لمستويات الطاقة؛ وبالنسبة لذرة الهيدروجين فإنه موضح بالشكل 2)). وهو بمثابة مقياس رأسي للطاقة مع خطوط أفقية مرسومة بحيث تناظر طاقات الحالات المستقرة للذرة. وقد بينا عدة مستويات أولى فقط، لأن تلك المستويات تصير عند قيم n الأعلى من ذلك متلاصقة لدرجة يصعب معها رسمها. ويتضح هذا من حقيقة أن كل المستويات بدءاً من n = 3 حتى n = ∞ لابد أن تقع داخل فجوة صغيرة بين – 1.51 eV والصفر. وحيث أن نصف قطر المدار يتزايد بسرعة بزيادة n فإن الإلكترون يصير متحرراً من النواة تماماً عند n = ∞، وتصير الذرة عندئذ مؤينة.

الشكل 2)): الرسم البياني لمستويات طاقة الهيدروجين. هناك عدد لا نهائي من المستويات فيما بين n = 4 و n = ∞.
نلاحظ أن هناك منطقة بالتعبير منطقة متصلة، وتقع لطاقات أكبر من الصفر. وعند قيمة n = ∞ يكون الإلكترون متحرراً من الذرة ويكون ساكناً. وتكون قيم الطاقة الأعلى بمثابة طاقة الحركة الانتقالية للإلكترون الحر. ولكن هذه الطاقة ليست مكماة ولذلك فإن جميع قيم الطاقة فوق E = 0 تكون متاحة.



|
|
|
|
تفوقت في الاختبار على الجميع.. فاكهة "خارقة" في عالم التغذية
|
|
|
|
|
|
|
أمين عام أوبك: النفط الخام والغاز الطبيعي "هبة من الله"
|
|
|
|
|
|
|
قسم شؤون المعارف ينظم دورة عن آليات عمل الفهارس الفنية للموسوعات والكتب لملاكاته
|
|
|