


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2024-03-02
التاريخ: 2025-01-18
التاريخ: 21-2-2017
التاريخ: 23-10-2020
|
إن الأمينات تحضر في المعمل بواحدة من الطرق العامة التالية وسوف نقوم بشرح كل طريقة على انفراد .
أ- تفاعلات التعويض النيوكليوفيلية بين الأمينات وهاليدات الالكيل : أمينة هاليدات الألكيل
ب- تفاعلات الاختزال : 1- اختزال مركبات النترو .
2- الأمينة الاختزالية .
3- اختزال النتريلات .
ج- ترتب الأميدات
(أ) التحضير بتفاعلات التعويض النيوكليوفيلية .
التفاعلات بين الأمونيا وهاليدات الألكيل :
نظراً لأن الأمينات وكذلك الأمونيا ومثلها الأمونيا تحمل زوجاً منالالكترونات غير المشتركة على ذرة النتروجين فإنها يمكن أن تعمل كعوامل نيوكليوفيلية في تفاعلات التعويض لأي هاليد الكيل . وتعتبر هذه التفاعلات من التفاعلات الشبيهة لتفاعل أي نيوكليوفيل آخر مع هاليد الكيل .
وينتج عادة من تفاعل الأمونيا أو أي أمين مع هاليد الألكيل ملح الأمين المناظر . كما يمكن الحصول على الأمين الحر من خلال معاملة ملح الأمين مع قاعدة مثل هيدروكسيد الصوديوم وكما في المعادلة التالية :
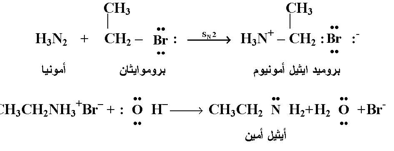
وهذا النوع من التفاعل يسمى بأمونينة الهاليدات ( Amonolysis of halides )؛ وإنه يعود إلى نوع التفاعلات التي أطلقتا عليها سابقاً بتفاعلات التعويض النيوكليوفيلية .
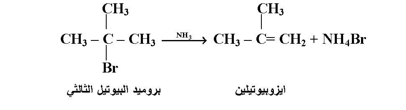
ولقد وجد أن درجة فعالية هاليدات الالكيل هي مثالية لتفاعل SN2العام هذا يعني أن تفاعل CH3X ≥ هاليدات الالكيل الأولية ≥ الثانوية بينما لا تعاني هاليدات الالكيل الثالثية تفاعلات تعويضية مع الأمونيا أو الأمين لأنها سوف تعاني من تفاعل انتزاع هاليد الهيدروجين لتعطي الألكينات كما يلي :
وتكمن المساوئ الرئيسية لتحضير الأمينات بهذه الطريقة في تكون أكثر من صنف واحد من الأمين ؛ والسبب في تكوين ذلك هو أن ملح الأمين الناتج يمكن أن يتبادل بروتون مع الأمونيا أو الأمين لينتج عنه تكون أكثر من نيوكليوفيل يتنافسون للتفاعل مع هاليد الالكيل .
لهذا فإنه سيتكون خليط من الأمينات الأحادية ، الثانوية ، والثالثية ، وغالباً يتكون ملح الأمونيوم الرباعي من تفاعل الأمونيا مع هاليد الالكيل كما بالمعادلات التالية :
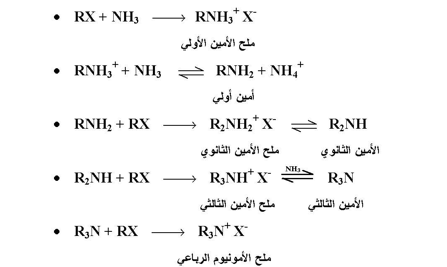
وعلى هذا الأساس ، فإنه للحد من تكون أكثر من ناتج ورغبة في الحصول على أمينات أولية ( أو الكلة أحادية ) فإنه يستحسن استخدام كميات كبيرة من الأمين أو الأمونيا نسبة إلى هاليد الالكيل .
وتحث مثل هذه الظروف سيكون هناك احتمال اكبر لاصطدام جزيئة من Rx مع جزيئة من الأمين المراد الكلتها . مثل المعادلة التالية :
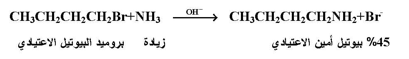
أما إذا رغب في الحصول على ملح الأمونيوم الرباعي ، فإنه يجب استخدام زيادة من هاليد الالكيل نسبة إلى الأمونيا أو الأمين كما بالمعادلة التالية :
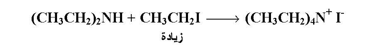
وفيما يلي بعض الأمثلة لتطبيق تفاعل امونينة الهاليدات في تحضير الأمينات :
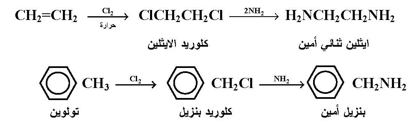
أما بالنسبة لهاليدات الاريل فإنه بسبب فعاليتها القليلة تجاه تفاعلات التعويض النيوكليوفيلية فإنها لا تستخدم لتحضير الأمينات الاروماتية إلا إذا توفرت فيها شروط زيادة الفعالية وهي :
أ- وجود مجاميع NO2 أو مجاميع ساحبة للإلكترونات لا تتأثر بظروف التفاعل وفي مواقع اورثو - وبارا - بالنسبة للهاليد .
ب- استخدام ظروف قاسية لإجراء التفاعل كزيادة درجة الحرارة أو استخدام قاعدة قوية جداً كنيوكليوفيل ؛ وسوف نتطرق إلى هذه التفاعلات وميكانيكياتها فيما بعد .
تفاعل فثاليميد جابريل لتحضير الأمينات الأولية :
لما كان من الصعب الحصول على الأمينات الأولية وبصورة نقية غير مخلوطة مع أمينات أخرى وذلك من خلال تفاعل هاليدات الالكيل مع الأمونيا ولأهمية هذه الأمينات فأنه استخدم تفاعل فثاليميد جابريل لتحضيرها .
ويتضمن التفاعل أكثر من خطوة : الخطوة الأولى هي تفاعل أنيون الفثاليميد كنيوكليوفيل مع هاليد الالكيل ( أولي طبعاً ) بتفاعل تعويضي نيوكليوفيلي من نوع SN2 . يعقبها بخطوة منفصلة تحال الفثاليميد المعوض باستخدام قاعدة والتي ينتج عنها الأمين الأولي :
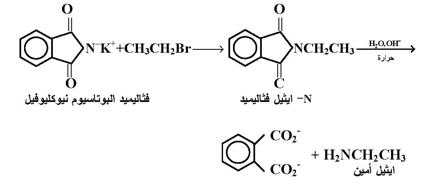
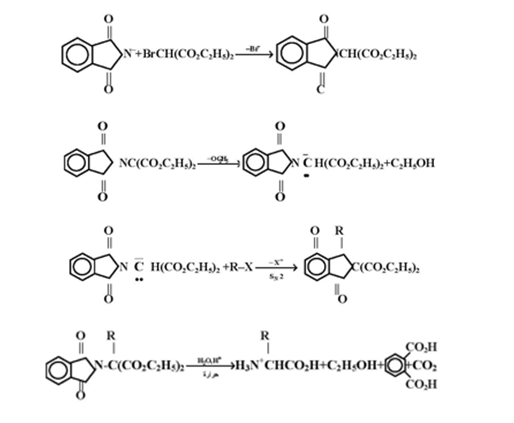
ولقد طور تفاعل فثاليميد جابريل واستغل لتحضير أحماض - ألفا - أمينو ، الوحدة البنائية للبروتينات ، يتضمن التتابع لتحضير هذه المركبات ما يلي :
أ- معاملة أنيون فثاليميد مع برومومالونات ثنائي اثيل ( BrCH [CO2C2H5] 2)
ب- معاملة أيميد المالونات ( Imide Malonate ) مع قاعدة وذلك لغرض افظ ذرة ألفا - هيدروجين وأخيراً
ج- معاملة الانيون الكاربوني مع هاليد الالكيل والتي ستؤدي إلى الكلة استر المالونيك والتي ستحرر الحامض عند تحللها وكما في التتابع التالي :
ب- تفاعلات الاختزال Reduction Reactions :
1- اختزال مركبات النتروReduction of Nitro Compounds :

تعتبر طريقة اختزال المركبات المحتوية على مجموعة نترو هي من أحسن الطرق للوصول إلى الأمينات شرط عدم احتواء المركب على مجموعة وظيفية أخرى قابلة للاختزال تحت ظروف التفاعل هذه .
وبالذات يمكن عدها من أمثل الطرق لتحضير الأمينات الأروماتية الأولية . ومن الممكن إجراء عملية الاختزال بواحدة من الطرق التالية :
اولا : الاختزال المحفز وذلك باستخدام هيدروجين وحافز . وتجرى هذه العملية عادة وبسهولة بإمرار غاز الهيدروجين على المحلول الكحولي المحرك لمركب النيترو بوجود غبار النيكل أو البلاديوم أو البلاتين ؛ كما بالمعادلة التالية :
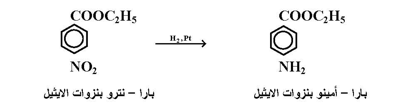
ومن المشاكل التي تعاني منها هذه الطريقة في التطبيق هي عدم إمكانية استخدامها في حالة كون مركب النيترو المراد اختزاله يحتوي على مجموعة قابلة للاختزال بالعامل المستخدم مثل رابطة كاربون – كاربون المزدوجة .
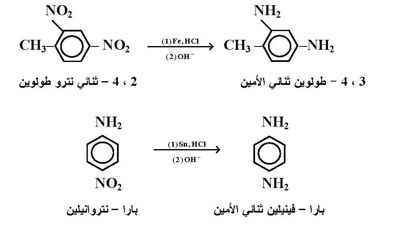
ثانياً : الاختزال باستخدام العوامل الكيميائية : تجري هذه الطريقة غالباً ؛ بإضافة حامض الهيدروليك المخفف على خليط لمركب النترو مع حبيبات فلز وغالباً يستخدم الحديد أو القصدير لهذا الغرض .
ويمكن الحصول على الأمين المراد تحضيره في نهاية التفاعل وذلك بإضافة قاعدة بهدف تحرير الأمين وذلك لأنه سوف يكون على شكل ملح ، وفيما يلي بعض الأمثلة لهذا التفاعل :
2- اختزال النتريلات :
من الممكن اختزال النيتريلات إما حفزياً ( هدروجين وحافز ) أو باستخدام عوامل كيميائية مثل هيدريد ليثيوم الومنيوم (LiAIH4) ليتكون من جراء ذلك الأمينات من النوع RCH2NH2 بمنتوجات نسبتها %70 تقريباً .
والنتريلات وكما هو معلوم يمكن تحضيرها من هاليدات الالكيل ، وعلى هذا الأساس يمكن استخدام هذه الطريقة لزيادة سلسلة الكاربون بذرة واحدة كما بالمعادلة التالية :

ترتب هوفمان :
لقد وجد بأنه عند معاملة أي أميد غير معوض RCONH2 مع محلول البروم القاعدي ؛ فأن الاميد سيعاني من ترتب لينتج الأمين المناظر . ويسمى هذا النوع من الترتب بترتب هوفمان .كما بالمعادلة التالية :
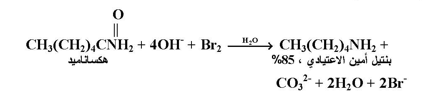
ونجد أن مجموعة الكاربونيل تفقد على شكل CO3-2 . وهذا يعني أن ترتب هوفمان يستخدم لتحضير أمين يحتوي على ذرة كاربون أقل من الأميد المبتدأ به 0
ويتبين أن التفاعل يسير بخطوات متتابعة ؛ تتضمن الخطوة الأولى عملية برومة الأميد عند ذرة النتروجين ؛ بعد ذلك وفي خطوة منفصلة تفقد جزيئة برومو أميد بروتون من ذرة النتروجين لتكوين أنيون غير مستقر .
وبعد ذلك تحدث عملية الترتب في الخطوة الثالثة والتي هي مشابهة لهجرة 1 ، 2 والتي تم التطرق اليها سابقاً ؛ سينتج عن عملية الترتب تكون مركب ايزوسيانيت .
وهذا النوع من المركبات يمكن أن يكون مستقراً تحت ظروف خاصة ولكن ليس تحت ظروف قاعدية لتكوين الأمين وأيون الكاربونات . توضح المعادلات التالية هذه الميكانيكية :
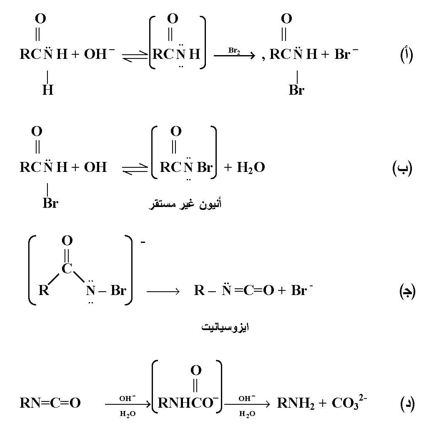



|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|