

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الرابطة الكيميائية قبل 1926 The chemical bond before 1926
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 6th ed
31-10-2016
4180
الرابطة الكيميائية قبل 1926 The chemical bond before 1926
يجب أن يبدأ أي اعتبار لبنية الجزيئات بمناقشة الروابط الكيميائية، تلك القوى التي تربط الذرات ببعضها البعض في الجزيء.
ستناقش الروابط الكيميائية، أولاً، في إطار النظرية التي طورت حتى عام 1926، ومن ثم في إطار النظرية الحالية لقد أدى إدخال ميكانيك الكم عام 1926، الى احداث تغيير جذري في المفاهيم حول كيفية تشكل الجزيئات وللملائمة ما زالت اللغة الأقدم والأبسط والتمثيلات التصويرية، تستخدم على الرغم من أن الكلمات والصور تعطي تفسيرات حديثة.
في عام 1916 وصف نوعان من الروابط الكيميائية: الرابطة الأيونية من قبل فالتر كوسل W.kossel (من ألمانيا)، والرابطة التكافؤية من قبل لويس G.N.Lewis (من جامعة كاليفورنيا). كلاهما، بنى أفكاره على أساس المفهوم التالي للذرة.
تحاط النوى الموجبة الشحنة بالالكترونات المرتبة في طبقات أو سويات طاقة متطابقة المركز. هنالك عدد أعظمي للالكترونات التي يمكن توضعها في كل طبقة: الكترونات في الطبقة الأولى، ثمانية في الطبقة الثانية، ثمانية أو ثمانية عشر في الطبقة الثالثة، وهكذا. تبلغ الاستقرارية العظمى عندما تكون الطبقة الخارجية مليئة، كما هي الحال في الغازات النادرة ينشأ كلا نوعي الروابط، الأيوني أو التكافؤي، من ميل الذرات لبلوغ هذا التشكيل الالكتروني المستقر.
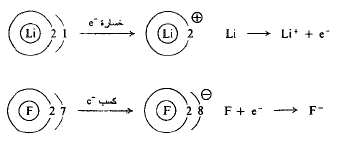
تحصل الروابط الأيونية من انتقال الالكترونات، كما في تشكيل فلوريد الليثيوم. على سبيل المثال، تملك ذرة الليثيوم الكترونين في طبقتها الداخلية والكتروناً في طبقتها الخارجية أو طبقة التكافؤ؛ يؤدي فقدان الكترون الى حمل الليثيوم ذا طبقة خارجية مليئة بزوج من الالكترونات. بينما تملك ذرة الفلور الكترونين في الطبقة الداخلية، وسبعة الكترونات في الطبقة الخارجية، طبقة التكافؤ؛ ويؤدي كسب الكترون واحد الى جعل الفلور ذا طبقة خارجية ممتثلة بثمانية الكترونات. يتشكل فلوريد الليثيوم، بانتقال الكترون من الليثيوم الى الفلور؛ يصبح الآن الليثيوم يحمل شحنة موجبة، والفلور يحمل شحنة سالبة. يسمى التجاذب الكهرساكن، بين الأيونات متعاكسة الشحنة، الرابطة الأيونية. تكون الروابط الأيونية، نوعية، في الأملاح المشكلة من اتحاد العناصر المعدنية (عناصر كهرجابية) الموجودة الى أقصى يسار الجدول الدوري، والعناصر اللامعدنية (عناصر كهرسلبية) الموجودة الى أقصى يمين الجدول الدوري.
تنشأ الرابطة التكافؤية من تشارك بالالكترونات، كما في حالة تشكل جزيء الهيدروجين على سبيل المثال. تملك كل ذرة هيدروجين الكتروناتً وحيداً؛ تكمل كلاهما الطبقة الالكترونية الخارجية الى الكترونين اثنين بعملية تشارك الكترونية. كذلك بالنسبة لذرتي فلور منها سبعة الكترونات في الطبقة الخارجية، تستطيع بلوغ الثمانية الالكترونية
بالتشارك في زوج من الالكترونات وبنفس الطريقة يمكننا ايضاح تشكل HF و H2O و HN3 و CH4 و CF4. وهنا أيضاً، تكون قوة الترابط قوة تجاذب كهرساكن، لكن هذه المرة بين كل من الالكترونين ولكلتي النواتين.
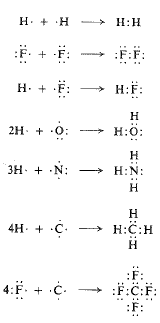
ان الرابطة المشتركة نوعية لمركبات الكربون وتكون الرابطة ذات الأهمية الرئيسة في الكيمياء العضوية.
مسألة: 1.1_ أي المركبات التالية تتوقع أن يكون أيوناً وأيها غير أيوني؟ اعطِ بنية الكترونية بسيطة لكل منها، مظهراً فقط، الكترونات طبقة التكافؤ.
(أ) KBr
(ب) H2S
(جـ) NF3
(د) CHCl3
(هـ) CaSO4
(و) NH4C1
(ز) PH3
(حـ) CH3OH
مسألة 2.1 اعطِ بنية الكترونية بسيطة محتملة لكل مما يلي، مفترضاً أنها تكافؤية بشكل تام. افترض أن كل ذرة (طبعاً ما عدا الهيدروجين) تملك ثمانية الكترونية، وأنه يمكن لذرتين أن تشارك بأكثر من شفع الكتروني.
(أ) H2O2
(ب) N2
(جـ) HONO2
(د) NO3-
(هـ) HCN
(و) CO2
(ز) H2CO3
(حـ) C2H6
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















