

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
طاقة كسر الرابطة. التجانس وعدم التجانس
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 22 - 6th ed
1-11-2016
12625
طاقة كسر الرابطة. التجانس وعدم التجانس
Bond dissociation energy. Homolysis and heterolysis
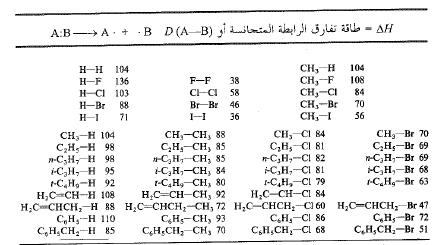
لقد رأينا الطاقة تتحرر عندما تتحد الذرات مشكلة الجزيء. ويجب استهلاك نفس الكمية من الطاقة لكسر الجزيء وتحويله الى ذرات. تدعي كمية الطاقة، الطاقة المستهلكة، أو المحررة، عند تحطيم رابطة أو عند بنائها، طاقة تفارق الرابطة، D. وهي كمية مميزة لكل رابطة. يتضمن الجدول (1.1) قائمة طاقات التفارق المقيسة لعدد من الروابط. وكما نرى، تختلف هذه الطاقات بعضها عن بعض الى درجة كبيرة بدءاً من الروابط الضعيفة مثل 1-1 (36 كيلو حريرة/مول). وعلى الرغم من أن بعض القيم المعتمدة تتغير كلما تحسنت الطرق التجريبية إلا أن الاتجاهات دائماً واضحة.
الجدول 1.1: طاقات تفارق الروابط المتجانسة (كيلو حريرة/مول)
يجب عدم الخلط بين طاقة تفارق الرابطة (D) وبين مقدار آخر لقوة الرابطة ويدعى طاقة الربط (E). فإذا بدأ المرء بالميتان مثلاً وأخذ يكسر الروابط الأربعة كربون – هيدروجين تباعاً، يحصل على أربع طاقات تفارق مختلفة.
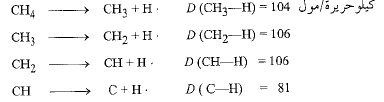
ومن ناحية أخرى، فإذان طاقة الرابطة كربون – هيدروجين في الميتان E (C-H) هي قيمة وسطية مفردة.
CH4 → C + 4H ΔH=397 kcal/mole
كيلو حريرة/مول E(C-H)=397/4=99،
وسوف نحد، بشكل عام، أن طاقة التفارق أكثر فائدة في توضيح ما نبتغيه لقد تحدثنا حتى الآن عن تحطيم جزيء ما إلى ذرتين أو إلى ذرة واحدة ومجموعة من الذرات. وهكذا يذهب كل الكترون من الالكترونين المؤلفين للرابطة الى كل شق، يدعى مثل هذا التحطيم، التحلل المتجانس hemolysis. وسوف نصادف أيضاً تفاعلات تتضمن تحطيماً للروابط من نوع مختلف؛ هو التحلل اللامتجانس heterolysis، الذي يذهب فيه الالكترونان الرابطان كلاهما الى نفس الشق.
متجانس: الكترون واحد لكل شق A : B → A. + .B
لا متجانس: كلا الالكترونين لشق واحدة A : B → A + :B
(أخذت هاتان الكلمتان من اليونانية: متجانس Homo، يعني الشيء ذاته، لا متجانس hetro؛ يعني مختلف؛ والجزء اللاحق lysis بالنسبة للكيميائي، التشطر، كما في تعبير hydrolysis الحلمهة، أي التشطر بوساطة الماء).
إن قيم طاقات التفارق المعطاة في الجدول (1.1) تعطي حالات التجانس ولذلك توافق طاقات تفارق متجانس للروابط. ولكن قيست أيضاً طاقات تفارق لا متجانس للروابط، وقد أعطيت بعضها في الجدول (1.1) التالي.
الجدول 3.1: طاقات تفارق الروابط غير المتجانسة (كيلو حريرة/مول)

إذا تفحصنا هذه القيم، وجدنا أنها أكبر بمقدار كبير من تلك المبينة في الجدول (1.1). إن التحلل البسيط اللامتجانس لجزيء معتدل يؤدي، بالطبع، الى أيون موجب (كاتيون) وآخر سالب (أنيون). يتطلب فصل (تفريق) هذه الجسيمات المشحونة بشكل متعاكس، كمية كبيرة من الطاقة: 100 كيلو حريرة/مول أو نحو ذلك أي أكثر مما يلزم لتفريق الجسيمات المعتدلة. ولذلك يحدث التفارق في الحالة الغازية، بشكل عام، وفق طريق أسهل هو الطريق المتجانس. أما في مذيب متأين من ناحية أخرى فإن التحلل اللامتجانس هو المفضل.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















