


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 31-7-2020
التاريخ: 2024-01-27
التاريخ: 2-3-2018
التاريخ: 16-2-2016
|
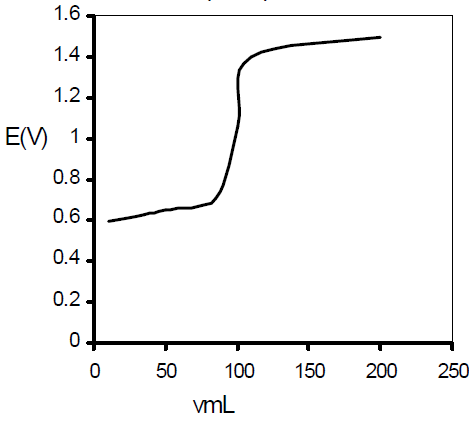
منحنيات معايرة التأكسد والأختزال
يتم رسم منحنيات الأكسدة والاختزال بالاستعانة بمعادلة نرنست ويعبر منحنى المعايرة عن التغير في تركيز المادة المراد تعينها ، وذلك بدلالة المادة القياسية ، وتوضح معادلة نرنست العلاقة بين الجهد والتركيز بذلك يمكن تمثيل منحنى معايرة الأكسدة والاختزال برسم العلاقة بين مللترات المادة القياسية (يمكن أن يكون عاملاً مختزلاً أو مؤكسدا ) وقيم الجهد التي تقابل كل إضافة ، ويتم حساب الجهد باستخدام معادلة نرنست التي توضحها العلاقة التالية.
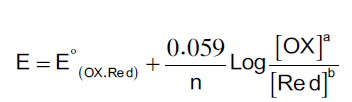
حيث تحسب قيم هذا الجهد مع التغير في تركيز محتويات الخلية أثناء المعايرة ويستخدم نصف الخلية القياسي (H+/ H2 ) لتقوم بدور نصف خلية مقارنة،أما في المعمل فيستخدم قطب الكالوميل المشبع كقطب مقارنة وذلك للحصول على منحنى المعايرة في التجارب العملية.
أن الوسيلة المناسبة لتوضيح هذه الحسابات هو أستخدام تفاعل السيريو م الرباعي Ce+4 مع الحديد الثنائي (الحديدوز) Fe+2 مثال:
عند معايرة 100 مل من محلول الحديدوز Fe+2 (0.1 N) مع محلول السيريوم الرباعي ( Ce+4 (0.1 N في وجود حمض الكبريتيك (1N) H2SO4 ثابت الاتزان لهذا التفاعل:
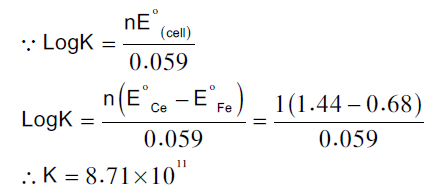

ومن مقدار قيمة (K) الكبيرة نستنتج أن التفاعل تام
الجهد الإبتدائي:
يتكون المحلول في البداية من Fe+2 فقط ربما توجد كمية قليلة جداً من Fe+3 نتيجة التأكسد بواسطة الهواء الجوي لذلك فإن حساب الجهد الأولي هنا ليس له معنى حقيقي ( أي لا يوجد تأكسد واختزال فلا يوجد جهد أولي )
الجهد عند اضافة 10 مل من السيريوم Ce+4
في البداية مللى مولات الحديدوز Fe+2 = 100 x 0.1= 10 مللي مول
مللى مولات السيريوم عند اضافة ( 10 مل) = 10 x 0.1= 1 مللي مول
المتبقي من الحديدوز في المحلول الكلي ( 110مل )= 9 مللي مول


الجهد عند منتصف المعايرة:أي عند إضافة 50 مل من السيريوم الرباعي Ce+4 ( 0.1N) فسيكون الجهد
في البداية مللى مولات الحديدوز Fe+2 = 100 x 0.1= 10 مللي مول
مللى مولات السيريوم عند اضافة (50 مل) = 50 x 0.1= 5 مللي مول
المتبقي من الحديدوز في المحلول الكلي ( 150مل )= 5 مللي مول


كما يمكن حساب الجهد عند أي إضافة قبل نقطة النهاية بالطريق نفسها .
الجهد عند إضافة 85 مل من السيريوم Ce+4 في البداية مللى مولات الحديدوز Fe+2 = 100 x 0.1= 10 مللي مول مللى مولات السيريوم عند اضافة (85 مل) = 85 x 0.1= 8.5 مللي مول المتبقي من الحديدوز في المحلول الكلي ( 185مل )= 8.5 مللي مول


الجهد عند نقطة التكافؤ:
الجهد عند نقطة التكافؤ أي إضافة ( 100 مل) من محلول السيريوم الرباعي Ce+4
[Fe+2] = [Ce+4] او [Fe+3] = [Ce+3]
ولما كان:
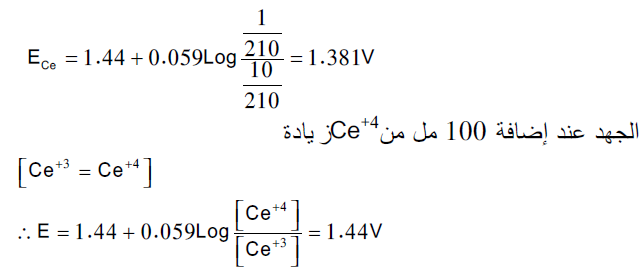

الجهد بعد نقطة التكافؤ:
عند إضافة ( 10) مل زيادة أي إضافة 110) مل ( من السيريوم Ce+4
في البداية مللي مولات Ce+3 =100 x 0.1= 10مللى مول
المتكون مللي مولات Ce+4 =10 x 0.1= 1 مللى مول




|
|
|
|
دخلت غرفة فنسيت ماذا تريد من داخلها.. خبير يفسر الحالة
|
|
|
|
|
|
|
ثورة طبية.. ابتكار أصغر جهاز لتنظيم ضربات القلب في العالم
|
|
|
|
|
|
|
سماحة السيد الصافي يؤكد ضرورة تعريف المجتمعات بأهمية مبادئ أهل البيت (عليهم السلام) في إيجاد حلول للمشاكل الاجتماعية
|
|
|