


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2023-09-19
التاريخ: 2024-02-07
التاريخ: 18-4-2017
التاريخ: 19-4-2017
|
يتكون هذا القطب من قطعة من البلاتين مغطاة بطبقة من حبيبات البلاتين المتساوية تسمى البلاتين الأسود لزيادة مساحة سطح القطب. ويتم غمر هذا القطب في محلول حمضي تكون فيه فاعلية أيون الهيدروجين = 1، وحيث إن الفاعلية في المحاليل المخففة تساوي التركيز، نستطيع القول إن تركيزH+] 1= [ مولار. ويمر خلال هذا المحلول غاز الهيدروجين ضغطه يعادل ضغطاً جوياً واحداً، فكما نرى أن قطب الهيدروجين عند استخدامه سيحدث فيه تفاعلان هما :

والذي يتحكم في حدوث أي من هذين التفاعلين هو نصف الخلية الثاني. فإذا كان بهذا النصف من الخلية قطب من عنصر ذي جهد كبير فهذا يعني أن هذا القطب يستقبل إلكترونات بسهولة، ومن ثُمَّ سيكون عاملاً مؤكسداً، وسيتم اختزال أيونات هذا العنصر في هذا النصف من الخلية عند توصيلها مع الهيدروجين، حيث سيتأكسد جزيء الهيدروجين. أما إن كان القطب من عنصر ذي جهد أيوني منخفض فإنه سيعطي إلكترونات إلى قطب الهيدروجين، وتقوم أيونات الهيدروجين الموجودة في المحلول بالتفاعل مع هذه الإلكترونات لتكون جزيئات الهيدروجين. وفي كلا هذين التفاعلين يكون جهد قطب الهيدروجين مساوياً للصفر والعلاقة التالية تمثل جهد الخلية :

بهذا نستطيع تحديد E للعديد من التفاعلات في الخلية الجلفانية المقترحة.
قد ذكرنا أنه من المستحيل تعيين الجهد للقطب الأحادي، لذا تم اختيار قطب الهيدروجين كمرجع، ولتتم عملية قياس الجهد تستخدم الخلية الجلفانية وتتكون هذه من جزأين أحد هذه الأجزاء هو قطب الهيدروجين، والجزء الآخر عبارة عن وعاء به القطب المعدني المراد تعيين جهده القياسي، ويكون هذا القطب مغموراً في محلول لأحد أملاح مادة القطب، ويصل بين جزئي الخلية قنطرة ملحية تحتوي على محلول كلوريد البوتاسيوم ليتم التوصيل الكهربائي بين طرفي الخلية. بالإضافة إلى ذلك يعمل محلول كلوريد البوتاسيوم في القنطرة الملحية على المحافظة على التعادل الكهربائي بين طرفي الخلية، وذلك عن طريق تحرك أيونات البوتاسيوم لمعادلة الشحنة السالبة التي قد تتكون في جزء القطب المعدني، أما أيونات الكلوريد فتتحرك لمعادلة أي تجمع للشحنات الموجبة في الطرف الآخر مما يعمل على استمرار التفاعل في الخلية، وترسم الخلية الجلفانية بحيث يكون القطب الذي يحدث عليه تأكسد إلى اليسار، والقطب الذي يحدث عليه اختزال يكون دائماً إلى اليمين.
عند توصيل طرفي الخلية بالجلفانوميتر فسيحدث التفاعل الكيميائي، وبعد فترة نرى أن الجلفانوميتر يقرأ 0.34 ،فولت، وهذا يدل على قيمة جهد الخلية. ويدل هذا التفاعل على أن قطب النحاس يمثل المهبط ويحصل عليه اختزال، وأن قطب الهيدروجين يمثل المصعد ويحصل عليه التأكسد :

الجهد القياسي لقطب النحاس هو 0.34 ، إذن يمكن تعريف الجهد القياسي للقطب المغمور في محلول تركيزه 1 مولار من أيونات القطب وعند درجة حرارة ο25C بأنه جهد الخلية الناتج من توصيل هذا القطب بالقطب الهيدروجيني، وعلى هذا الأساس تم تعيين الجهد القياسي للعديد من الأقطاب، وقد تم تسجيل قطب الاختزال لتسهل مقارنة هذه الجهود ومن ثم تحديد كل من قوة العامل المؤكسد والمختزل ومدى قوة كل عامل، وذلك من مقارنة قيمة الجهد لهذا المعدن بجهد قطب الهيدروجين.
نستطيع القول إن قيم οE تعطي طريقة للمقارنة بين مواقع الاتزان عندما يفقد العنصر الإلكترونات. وكلما كانت قيمة E سالبة أكثر فإن هذا يعني ا أن الاتزان يتحرك نحو اليمين، أي أن هذا المعدن يفقد إلكتروناته بسهولة، وعلى العكس كلما كانت قيمة οE أكثر موجبيه فإن الاتزان يتحرك نحو اليسار، أي أن المعدن لا يفقد الإلكترونات بسهولة وتكون قابليته ليتأكسد ضعيفة أو بمعنى آخر لديه قابلية لاكتساب الإلكترونات، ومن ثم سيكون عاملاً مؤكسداً، ففي حالة الكلور :

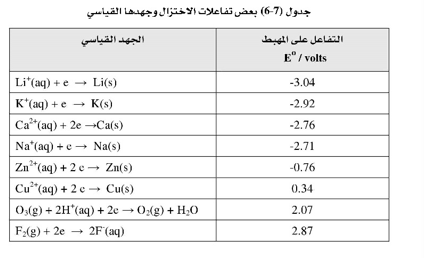
وكما يظهر من هذه المعادلة فإن قابلية أيون الليثيوم لاكتساب الإلكترونات تُعَدُّ ضعيفة جداً ، لذا فإن الليثيوم في المحلول سيعطي الإلكترونات بسهولة، أي أنه سيتأكسد. وفي الوقت نفسه سيكون عاملاً مختزلاً قوياً. وباتباع هذه الطريقة من قياس الجهد للعديد من التفاعلات تم إنشاء السلسلة الدافعة الكهربية. والجدول 6-7 يبين جزءًا من هذه السلسلة، حيث يكتب تفاعل نصف الخلية في حالة الاختزال. ويظهر الجهد القياسي لهذه التفاعلات.


|
|
|
|
دخلت غرفة فنسيت ماذا تريد من داخلها.. خبير يفسر الحالة
|
|
|
|
|
|
|
ثورة طبية.. ابتكار أصغر جهاز لتنظيم ضربات القلب في العالم
|
|
|
|
|
|
|
سماحة السيد الصافي يؤكد ضرورة تعريف المجتمعات بأهمية مبادئ أهل البيت (عليهم السلام) في إيجاد حلول للمشاكل الاجتماعية
|
|
|