

|
أقرأ أيضاً
التاريخ: 2023-03-08
التاريخ: 2023-02-27
التاريخ: 2023-02-22
التاريخ: 2023-08-03
|
على الرغم من الألمنيوم هي العنصر المعدني الأكثر وفرة في قشرة الأرض ( ويعتقد أن 7.5 إلى 8.1 في المائة) , فإنه من النادر في شكل حر، ويحدث في البيئات التي تفتقر إلى الأكسجين، مثل البراكين الطينية، وكان يعتبر المعدن الثمين أكثر قيمة من الذهب نابليون الثالث، إمبراطور فرنسا، كان يزعم انه أقام مأدبة طعام حيث أعطى أكثر الضيوف شرفا أواني من الألومنيوم، في حين أن الآخرين من الضيوف أعطاهم الذهب. وقد اكتمل نصب واشنطن التذكاري، مع 100 أوقية 2.8( كلغ ) من الألومنيوم باعتباره اللمسة الأخيرة والتي تم وضعها في مكان في يوم 6 ديسمبر 1884 ، وذلك في حفل إخلاص متقن. وكانت أكبر قطعة مفرده من الألومنيوم في ذلك الوقت. وفي ذلك الوقت الألمنيوم، كان غالى مثل الفضة. وقد تم إنتاج الألومنيوم بكميات تجارية في ما يزيد قليلا على 100 سنة.
البوكسيت:
الألومنيوم يعتبر فلز ذات طبيعة تفاعليه قوية والذي يكون روابط كيميائية ذات طاقة عالية مع الأكسجين بالمقارنة مع معظم المعادن الأخرى فإنه من الصعب استخراجه من الخام، مثل البوكسايت، ويرجع ذلك إلى الطاقة اللازمة لتقليل أكسيد الألومنيوم (3O2 A1). على سبيل المثال، الاختزال المباشر مع الكربون، باعتباره يستخدم لإنتاج الحديد، لا يمكن كيميائيا، لأن الألومنيوم عامل اختزال أقوى من الكربون. أكسيد الألومنيوم له درجة انصهار نحو2,000 C . في هذه العملية، أكسيد الألومنيوم يذوب في الكرايوليت المنصهر وبعد ذلك يختزل إلى الفلز النقي. درجة الحرارة التشغيلية للحد من الخلايا حوالي 950 إلى C° 980 . كما وجد الكرايوليت بعلم المعادن في جرينلاند، ولكن في الاستخدام الصناعي فقد استعيض الاصطناعية الجوهر. الكرايوليت هو مركب كيميائي من الألومنيوم والصوديوم والكالسيوم والفلوريد : (6AlF3Na) أكسيد الألومنيوم ( مسحوق أبيض) ويتم الحصول عليه بتكرير البوكسايت في عملية باير لكارل باير. (السابق، عملية ديفيل وكانت هي الغالبة في تكنولوجيا التكرير).
كما ذكر سابقاً فإن مادة الألومنيوم شديد الارتباط مع الأكسجين بحيث يصعب فصلهما . بالمقارنة مع الفلزات الأخرى، فإنه من الصعب أن يتم فصله من خاماته، مثل البوكسيت، وذلك نظراً إلى الطاقة اللازمة لإرجاع أكسيد الألومنيوم 3O2 A1. على سبيل المثال، فإن الإرجاع المباشر بالكربون كما يتم مع الحديد غير ممكن كيميائياً، لأن الألمنيوم بحد ذاته عامل مرجع أكثر قوة من الكربون. وبما أن لأكسيد الألمنيوم نقطة انصهار عالية نسبياً حوالي 2000 س لذلك فإن الألمنيوم يستحصل عن طريق التحليل الكهربائي. يحل أكسيد الألومنيوم في هذه العملية في الكريوليت 6AlF3Na المذاب، من ثم يرجع إلى الفلز النقي. تكون درجة حرارة التشغيل لخلايا الإرجاع من 950 إلى 980س. يتواجد الكريوليت كمعدن في غرينلاند، أما أكسيد الألومنيوم فيستحصل من معالجة البوكسيت بطريقة باير
التحليل الكهربائي :
إن طريقة التحليل الكهربائي للحصول على الألومنيوم حلت محل طريقة فولر Wöhler process ، والتي كانت تتضمن إرجاع كلوريد الألومنيوم اللا مائي بالبوتاسيوم. كل من المسريين المستعملين في عملية التحليل الكهربائي مصنوعان من الكربون. عندما تصبح الخامة في الحالة المنصهرة تتحرر:
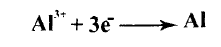
الشوارد (الأيونات) وتصبح حرة الحركة، وتحدث العمليات التالية على المساري على المهبط (الكاثود) ، المسرى السالب نحصل على الألومنيوم.
يلاحظ هنا أن الألومنيوم حدثت عليه عملية إرجاع (ربح إلكترونات).
ويتشكل الألمنيوم الحر بشكله الفلزي، ويهبط إلى القاع. على المصعد (الأنود). المسرى الموجب؛ يتحرر الأكسجين.
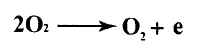
باستمرار تعرض مسرى الكربون للأكسجين تحدث عملية أكسدة له حيث يتشكل ثنائي أكسيد الكربون.
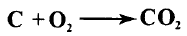
لذلك يجب استبدال قضبان الكربون على المسرى الموجب باستمرار كونها تستهلك أثناء سير العملي.
ويتم الحصول على الألمنيوم من البوكسيت، وهو أكسيد المنيوم مميه. يتكون البوكسيت من الألمين( 50-60 % ) Al2O3 والسيليس (5-3 %) وأكسيد التتان (4-2 %) وأكسيد الحديد 20-30%. ويصعب في حالة الألمنيوم تطبيق الطرائق التقليدية المتبعة في استحصال المعادن، إذ يتم فيها تحضير المعدن أو محلول له) مشوباً في بادئ الأمر ثم ينقى من شوائبه، ذلك لأن الألمنيوم شديد القابلية للتأكسد. لذا تعتمد طرائق تحضيره على استحصال الألمين بدرجة نقاوة عالية ثم تحليله كهربائياً.
ولتنقية الألمين وفق طريقة باير الأكثر شيوعاً يعالج خام البوكسيت تحت ضغط مرتفع بمحلول الصودا الكاوي (هيدروكسيد الصوديوم) المركز الساخن فيذوب السيليس متحولا إلى سيليكات، ويذوب أكسيد التتان متحولا إلى التيتانات، وتذوب أكاسيد الألمنيوم متحولة إلى ألومينات Na3AlO3 او NaAlO2

وأما أكسيد الحديد Fe2O3 فيترسب على شكل وحل أحمر.
يُفصل محلول ألومينات الصوديوم من الرواسب بالمرشح الضاغط ويرسب الألمين من الرشاحة بالتبريد والتخفيف بالماء وإمرار غاز ثاني أكسيد الكربون الذي يتفاعل مع هدروكسيد الألمنيوم ويعجل بذلك في انفصال هدروكسيد الألمنيوم :

يُفصل هدروكسيد الألمنيوم من المحلول بالترشيح ويتم غسله جيداً بالماء ثم يكلس في أفران دوارة تبلغ درجة الحرارة فيها نحو 1000س للحصول علـى الألمين الجاف:

يُشحن الألمين اللامائي الناتج إلى وحدات المعالجة بطريقة هول - هيرو حيث يُرجع بالتحليل الكهربائي في خلية (حمام) نموذجية تتألف من حوض فولاذي مستطيل مبطن بالأجر العازل والكربون يحوي متحللاً بالكهرباء (إلكتروليت) مؤلفاً من الألمين والكريوليت المنصهر (الكريوليت ملح مضاعف الفلوريد الألمنيوم وفلوريد الصوديوم بنسبة جزيء من الأول إلى ثلاثة جزيئات من الثاني) (3NaF AlF3). ويغطي القعر الكربوني مفرش من الألمنيوم المصهور يعمل مهبطا . وتعلق في المتحلل الكهربائي كتل من الكربون سبق تحميصها، ويُستخدم الكربون مصعداً لأنه لم تعرف حتى الآن مادة بديلة تقاوم المفعول المتآكل لمصهور الفلوريد ولأنه مرجع متحلل بالكهرباء (كهرليتي) مناسب للألمين . ويمر التيار المهبطي بالقعر الكربوني عن طريق قضبان فولاذية متصلة بالمهبط.
إن آلية التفاعلات التي تحدث داخل الخلية غير معروفة على وجه الدقة. وأبسط النظريات تفترض تأين (تشرد ) الألمين في درجات الحرارة العالية. وفي أثناء التحليل الكهربائي يتوضع الألمنيوم على المفرش المعدني أي المهبط ويتحرر الأكسجين عند المصعد ليتفاعل مع الكربون معطيا ثنائي أكسيد الكربون (C). كما يُرجع الكربون قسماً من CO2 إلى أحادي أكسيد الكربون CO بتفاعلات ثانوية. وبعد فواصل زمنية تراوح بين 24 و 48 ساعة يترك مصهور الألمنيوم يسيل متعب (سيفون) siphon من أنبوب بشكل W متصل بالخلية.
يتطلب إجراء هول مقادير كبيرة من الطاقة الكهربائية (نحو 14000 كيلو واط / ساعة للحصول على الطن الواحد ) وتعتريه مشكلة التلوث بالفلوريد السام.
|
|
|
|
علامات بسيطة في جسدك قد تنذر بمرض "قاتل"
|
|
|
|
|
|
|
أول صور ثلاثية الأبعاد للغدة الزعترية البشرية
|
|
|
|
|
|
|
مكتبة أمّ البنين النسويّة تصدر العدد 212 من مجلّة رياض الزهراء (عليها السلام)
|
|
|