


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 18-5-2016
التاريخ: 2024-08-06
التاريخ: 2024-01-01
التاريخ: 2024-01-01
|
ثمة الكثير من المنشورات عن خواص وسلوك المعادن في البيئة. وثمة معلومات كثيرة أيضاً عن مستويات قياسية لها في أنواع مختلفة من الماء، وكثير من الأمثلة التي تشرح التلوث بالتفصيل. وفي هذا المقطع، سوف نركّز الاهتمام في كيفية التعبير عن المبادئ التي ذكرناها سابقاً في ثلاث حالات هامة تمثل معدناً من النوع A، ومعدناً انتقالياً، ومعدناً من النوع B.
الكالسيوم(Calcium)
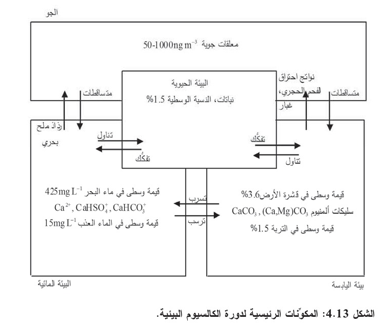
الكالسيوم، الذي تساوي نسبته 3.6% من قشرة الأرض، هو خامس أكثر العناصر وفرة (الملحق ب-1) ومن صيغ الكالسيوم المعدنية الهامة حجر الجير 3CaCO والدولوميت(CaCO3)CaMg إضافة إلى معدنيات سليكات ألمنيوم من قبيل الفلسبار(feldspar) أنورثيت (anorthite) والصلصال المعدني مونتموريلنيت (montmorillonite). وتسبب عوامل الطقس انحلال بعض الحجر الجيري في الماء، والمعدنيات الأخرى بمعدل أقل. وتحدّد قابلية انحلال معدن معين مع العوامل البيئية الأخرى، وخاصة تركيز أجناس الكربونات في الماء، التركيز النهائي للكالسيوم في التجمع المائي.
وبقطع النظر عن الصيغة المعدنية، يشترك الكالسيوم بحالة أكسدة عامة واحدة+ 2 هي ولذا لا يتأثر مباشرة بحالة إرجاع الماء وأكسدته وهو معدن من النوع A، ويُعتبر سلوكه في البيئة المائية من مميزات تلك الفئة. لذا يقترن عادة ببيئة ربيطات أكسجين معطية، أي إنه يستطيع، بالإضافة إلى تعقيده مع الأجناس المائية، تكوين معقدات مع أجناس من قبيل الفوسفات والكربونات والكبريتات حين وجودها. وفيما عدا حالة محاليل التربة، يوجد الفوسفات عادة بتراكيز منخفضة تجعل تفاعله مع الكالسيوم غير ذي شأن. وعندما تكون تراكيز الكربونات (أو كربونات الهدروجين عادة ) والكبريتات ضمن مجال الـ -1mmolL ، تكتسب معقداتها مع الكالسيوم بعض الأهمية.
وتبعاً لقيمة ثابت الاستقرار (الجدول 3.13 )يتفاعل الكالسيوم بدرجة صغيرة مع المادة البالية المنحلة. ويتضمن الربط ربما مجموعات وظيفية تحتوي على الأكسجين. وتبعاً لتركيز المادة الدُّبالية المنحلة في ماء عامل حموضته قريب من الطبيعي، يمكن لجزء صغير، لكن ملحوظ من الكالسيوم أن يكون بصيغة معقدة. وفي ظروف حمضية إلى حد ما، تتنافس أيونات الهدروجين تنافساً شديداً على مواقع على المادة الدبالية، ويعود الكالسيوم إلى صيغة أيونية بسيطة. ويكون الكالسيوم أيضاً معقدات ضعيفة مع الأيونات السالبة لبعض الحموض العضوية التي تُعتبر الأوكسالات والليمونات مثالين عليها. على سبيل المثال، في محلول يحتوي على
2.1mgL-1 Ca+2 و 2.3mgL-1 من الأوكسالات عند 6.5=pH، تساوي نسبة الكالسيوم الموجودة بصيغة معقدة منحلة نحو 0.1%. حين إجراء هذه الحسابات، استعملت لثابتي الاستقرار f1K وf2K القيمتان 110×4.6 و 110×1.1. وسوف تنافس معادن أخرى موجودة في الماء الكالسيوم طبعاً على مواقع على ربيطة التعقيد.
ويحتوي معظم المواد المعدنية المعلقة والراسبة على الكالسيوم بنسب مئوية صغيرة. وتعزز الظروف الحمضية تفكك الكالسيوم من هذه المواد الصلبة. لذا تزيد السيرورات الداخلية والخارجية التي تولد حموضاً، ومن أمثلتها المطر الحمضي والنترتة وغيرهما، من تركيز الكالسيوم في الماء. وهذا صحيح على وجه الخصوص حيثما يوجد الكالسيوم بصيغة معدنيات الكربونات. وفي التربة، يُعتبر الكالسيوم الأيون الرئيسي الذي يحتل مواقع المبادلة على المواد العضوية والمعدنية (انظر الفصل الثامن عشر). ويُزاح الكالسيوم القابل للمبادلة أيضاً بسهولة بحموضة الماء الذي يمر عبر التربة.
يُلخص الشكل 4.13 المكوّنات الرئيسية لدورة الكالسيوم البيئية.
النحاس(Copper)
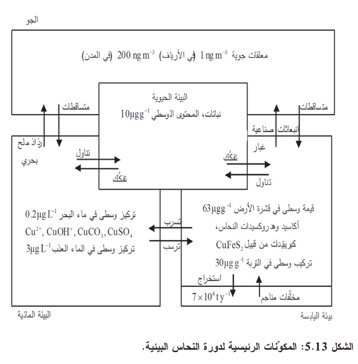
النحاس عنصر هام اقتصادياً، وهو متوفّر بمقادير ضئيلة جداً في قشرة الكرة الأرضية (التركيز الوسطي في الكرة الأرضية يساوي 63 -1ggμ) ( قد يكون من المفاجئ أن كثيراً من العناصر الشهيرة بسبب أهميتها الاقتصادية أقل وفرة عملياً في قشرة الأرض من عناصر أخرى أقل شهرة. قارن القيم في الملحق ب 1- للنحاس والسيريوم، على سبيل المثال). ويحتاج كل من النباتات والحيوانات إلى النحاس بوصفه مغذِّياً بمقادير ضئيلة جداً، لكن عندما تزداد تلك المقادير إلى ما فوق مستوى معين تصبح سامة. وتتضمن صيغه المعدنية النحاس الصافي، وعدداً من أجناس السليكات والأكاسيد، ومعدنيات كبريتيد نحاس وحديد ممزوجة من قبيل الشالكوبايريت CuFeS, chalcopyrite . أما حالة أكسدة النحاس الرئيسية في البيئة المائية فهي +2 وثمة أجناس معروفة من النحاس الأحادي التكافؤ إلا أنها تتفكك لتكوين النحاس (0) والنحاس (II) في معظم الحالات. وأحد الاستثناءات في ماء البحر هو أن أجناس كلور النحاس (I) مستقرة في الظروف المرجعة.
ينتمي النحاس إلى المعادن الانتقالية، ولذا يتصف بمقدرة جيدة على تكوين معقدات مع ربيطات متنوعة ، إلا أن الربيطات ذات ذرات الأكسجين المعطية هي المفضلة. وفي الماء الطبيعي العذب المتوازن مع الغلاف الجوي، يمثل معقد النحاس المائي الجنس الرئيسي عند قيم pH المنخفضة. وضمن مجال قيم pH المعتدلة، تصبح الصيغ المنزوعة البروتونات جزئياً هامة على غرار المعقد مع كربونات الهدروجين. وعند قيم pH العالية، يحصل مزيد من انتزاع البروتونات ويتكون معقد يتضمَّن أَيونَيْ كربونات (الجدول 2.13).
وعلى غرار ما يحصل مع المعادن الانتقالية ومعادن النوع B، يهيمن على كيمياء النحاس المائية تفاعله مع المادة العضوية. ففي خليج ساغيناو في بحيرة هورون، تبيَّن أن أكثر من 98% من النحاس موجود بصيغة معقدات مستقرة . مع مادة عضوية.
وفي كثير من الحالات، تتكون تلك المعقدات من المعدن والمادة الدبالية المنحلة. ومن المحتمل أن نسبة صغيرة من النتروجين الموجود في هذه المادة العضوية تؤدي دوراً هاماً في الارتباط مع النحاس وتكوين أجناس مستقرة. وحينما تكون المادة الدبالية موجودة بصيغة منحلة في الماء، تعمل على زيادة قابلية النحاس للانحلال وبالعكس، تعمل المادة الدبالية الجسيمية، أكانت معلقة أم راسبة، على إزالة النحاس المنحل من عمود الماء.
يلخص الشكل 5.13 السمات الهامة لدورة النحاس في الكرة الأرضية.
الزئبق (Mercury)
درست كيمياء الزئبق البيئية باستفاضة، وعلى وجه الخصوص بسبب عدة حوادث تسمم أدت إلى علل مزمنة ووفيات. ولعل أشهر تلك الحوادث ما حصل في ميناماتا، وهي قرية صيد سمك يابانية في أواسط القرن العشرين. فقد مات مئات الناس بسبب تناول سمك احتوى ما يصل إلى 100-1ggμ من الزئبق. وكان مصدر الزئبق فضلات محفّز +2Hg من مصنع كلور متعدد الفينيل كانت تصب في الخليج الواقع على المحيط.
يقل تركيز الزئبق في قشرة الأرض بثلاث مراتب كبر عن تركيز النحاس، ويساوي تركيزه الوسطي في الكرة الأرضية 89 1ngg- . وحيثما وُجد في الطبيعة، يكون بصيغته العنصرية أو مركباً مع الكبريت. وأهم صيغه المعدنية هي السينبار cinnabar، وهي صيغة من كبريتيد الزئبق ( -HgS (II α . ويمكن أن يوجد في البيئة المائية ورواسبها على شكل جنس 0 أو 1 أو +2 تبعاً لظروف الإرجاع والأكسدة وغيرها من الظروف البيئية. وتمثل صيغ الزئبق (II) أهم الأجناس المائية حين توفر ظروف تهوية.
وتميل معقدات الزئبق المائية إلى التخلي عن بروتوناتها بسهولة. لذا، وحتى في ظروف الحموضة المعتدلة عند 4=pH، يكون معقدا أحادي وثنائي الهدروكسي الصيغتين المهيمنتين إذا لم يكن ثمة عامل تعقيد آخر. والزئبق (II) هو معدن من النوع B، وإحدى نتائج ذلك ألفته القوية للكبريت المتجلية في أكثر صيغه المعدنية شيوعا. وميله إلى تكوين معقدات مع ربيطات مخلبية قوي أيضاً، و وهذا واضح في الشكل 3.1 حيث رأينا أن جنس الزئبق (II) الرئيسي هو (HgCl (aq حتى لو تدنى تركيز أيونات الكلور في ماء البئر حتى 9.5gmL-1 μ. ويتصف الزئبق (II) بألفة شديدة للربيطات العضوية في الماء أيضاً. وفي ماء مسامات تربة الغابة الغنية بالمادة العضوية، يوجد كل الزئبق المنحل على شكل معقدات مادة عضوية قابلة للانحلال. وقد قُدّرت ثوابت استقرار المعقد المكون مع من نسبة 1:1 من الزئبق والمادة الدُّبالية بقيم تقع في المجال من 1018 حتى 1020. ويمكن للروابط أن تتضمن مجموعات النتروجين والكبريت الموجودة بمقادير صغيرة في المادة الدبالية، إضافة إلى المجموعات الوظيفية التي تحتوي على الأكسجين والتي هي أكثر شيوعاً.
ويتصف الزئبق (II) بالمقدرة على تكوين رابط مع الكربون بصيغة زئبق الميثيل. وتحصل الميثلة methylation في ظروف لاهوائية من خلال سيرورة وسيط من متعضيات مكروية تتضمن نقل مجموعة ميثيل من الميثيلكوبالامين methylcobalamin ، وهو مشتق من الفيتامين B12 ، إلى ذرة زئبق. يتطلب هذا التفاعل ظروفاً مُرجعة لأن الميثيلكوبالامين يتكون بفعل الجراثيم المولّدة للميثان. في البيئة اللاهوائية، يحصل تفاعل تنافسي يُرجع فيه الزئبق (II) إلى حالته المعدنية، أو يتفاعل في حالة وجود رواسب محتوية على الكبريتات مع الكبريتيد (المتكون في أثناء الإرجاع) لتكوين مركب زئبق (II) شديد صعوبة الانحلال في الماء.
وتحصل سيرورة أخرى في الظروف الهوائية ضمن خلايا جرثومية حيث يرتبط الزئبق مع إنزيم، وتنتقل بعدئذ مجموعة ميثيل إلى الزئبق.
تنشط كلتا السيرورتين عند عامل الحموضة المنخفض نسبياً وتؤديان إلى تكوين زئبق (II) أحادي الميثيل +CH3Hg . ويكون هذا الأيون معقدات بسهولة مع ربيطات متنوعة. على سبيل المثال، تتكون مركبات من قبيل CH3HgCl و CH3Hg)2S) عالية استقرار تجاه انكسار الرابط Hg - C . إلا أن تفككه الكيميائي والكيميائي الضوئي والحيوي يحصل في الواقع إلى حد ما.
ويحصل مزيد من الميثلة أيضاً لتكوين زئبق ثنائي الميثيل (CH). وهذا المركب المعتدل متطاير وشديد صعوبة الانحلال في الماء. وعندما يصبح في الجو، يتحلل ضوئياً ليعطي أيونات زئبق (II) تتساقط مع المطر.
ليست الميثلة البيئية مقتصرة على الزئبق. فقد شوهدت مشتقات ميثيلية للقصدير (IV) والرصاص (IV) في أماكن طبيعية غير ملوثة. وتتضمن الآلية ميثلة مؤكسدة لأيونات الرصاص (II) أو القصدير (II) بواسطة أيون ميثيل كربوني موجب. وهذه سيرورة مختلفة تماماً عن تلك الخاصة بالزئبق (II) حيث يحصل الانتقال بواسطة أيون ميثيل كربوني سالب من الميثيلكوبالامين.



|
|
|
|
دراسة: حفنة من الجوز يوميا تحميك من سرطان القولون
|
|
|
|
|
|
|
تنشيط أول مفاعل ملح منصهر يستعمل الثوريوم في العالم.. سباق "الأرنب والسلحفاة"
|
|
|
|
|
|
|
لتعزيز التواصل مع الزائرات الأجنبيات : العتبة العلويّة المقدّسة تُطلق دورة لتعليم اللغة الإنجليزية لخادمات القسم النسويّ
|
|
|