


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 27-11-2015
التاريخ: 2023-09-26
التاريخ: 2024-02-17
التاريخ: 2024-02-14
|
لقد ثبت أن القوة الدافعة الكهربائية لخلية ما دالة في التركيز الأيوني لمحلول وبما أن عملية المعايرة تشمل على تفاعلات أيونية ، وتغيرات في تراكيز المتفاعلات ، فلابد أن يرافق عملية المعايرة تغيرات مماثلة في القوة الدافعة الكهربائية للخلية ، وهناك بعض تفاعلات المعايرة الهامة ، مثل معايرة الأحماض والقواعد ، ومعايرات الأكسدة والاختزال ومعايرات الترسيب ، ويمكن إجراء هذه المعايرات في جهاز كمـا بالشكل التالي :

ويتكون من قطب مرجع مثل قطب الكالوميل المشبع وقطب انتقائي للأيون تحت الاختبار ، موصل بجهاز قياس فرق الجهد ، كجهاز قياس الرقم الهيدروجيني ، ويوضع القطبان في دورق يحتوي علي المحلول المعاير ويقلب باستخدام مقلـــب مغناطيسي ، ويضاف المحلول الثاني تدريجيا باستخدام سحاحة مناسبة ، ويقاس فرق جهد الخلية بعد كل إضافة .
معايرة حمض بقاعدة :
تجري المعايرة باستخدام خلية تتكون من قطب الكالوميل المشبع كمرجع ، وقطب الزجاج ، وجهد هذه الخلية يعطي بالعلاقة :
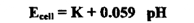
حيث K مقدار ثابت يعتمد علي القطب المرجع ، وجهد النقاء السوائل في الخلية ، ويمكن تحديد قيمته بقياس القوة الدافعة للخلية، باستخدام محلول منظم ذي رقم بين هيدروجيني معلوم ويرسم العلاقة بين Ecell أو pH مقابل حجم القاعدة المضاف نحصل على منحني ، كالمبين في الشكل
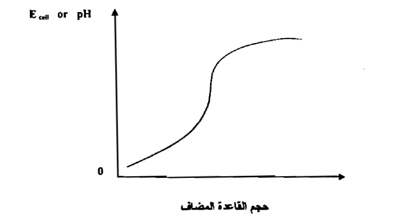
ومن الجدير بالذكر أنه يمكن استخدام هذه الطريقة لحساب ثابت التأين لحامض ضعيف أو لقاعدة ضعيفة .
مثلا ، معادلة التأين لحامض ضعيف (HA) هـي
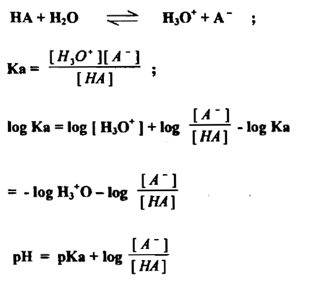
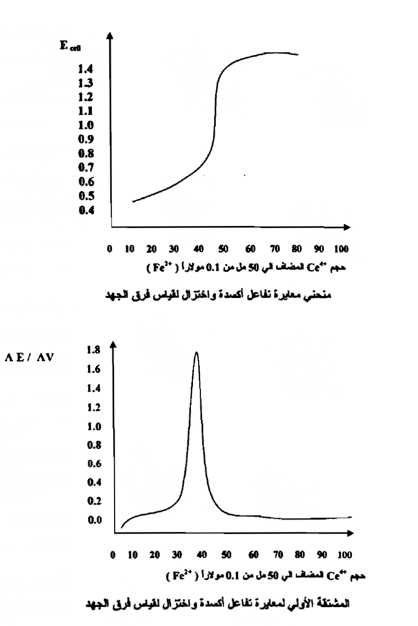
منحنيات المعايرة لتفاعلات الأكسدة والاختزال بقياس فرق الجهد :
في تفاعل الأكسدة والاختزال التالي :
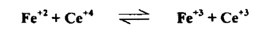
لنفترض أنه لدينا 50 مل من محلول أيونات الحديدوز ( +2 Fe ) تركيز ( N 0.1 ) يتم معايرته بمحلول يحتوي على أيونات / Ce+4 تركيزه ( N 0.1 ) في وجود حامض الكبريتيك ويمكن تتبع التغير في فرق الجهد باستخدام الخلية الكهروكيميائية التالية :

وبتطبيق معادلة نرنست على هذه الخلية واستخدام التركيزات بدلاً من الفعاليات

عند البداية : يحتوي المحلول على مللي مكافئ من أيونات الحديدوز فقط Fe2+ أما تركيزات أيونات الحديديك - إن وجدت - فمقدارها مهمل ؛ ولذلك لا يوجد فرق جهد ذي أهمية .
بعد إضافة 5 مل من محلول السيريك ( Ce+4 ) تتفاعل أيونات السيريك مع الحديدوز تفاعلاً تاماً ، وتتحول إلى سيروز محولة مقداراً مكافئاً من الحديدوز إلى حديديك ويصبح تركيز الأيونات في المحلول كالآتي :

والشكلين التالين يوضحان ذلك :



|
|
|
|
للعاملين في الليل.. حيلة صحية تجنبكم خطر هذا النوع من العمل
|
|
|
|
|
|
|
"ناسا" تحتفي برائد الفضاء السوفياتي يوري غاغارين
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|