

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
قطبية الجزيئات Polarity of molecules
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 24 - 6th ed
1-11-2016
16080
قطبية الجزيئات Polarity of molecules
يكون الجزيء قطبياً إذا لم ينطبق مركز الشحنات الموجبة فيه على مركز الشحنات السالبة. يؤلف الجزيء هكذا ثنائي قطب dipole (أي جزيء ثنائي قطب). والذي يعني شحنتان متساويتان ومتعاكستان بالإشارة، تفصل بينهما مسافة ما. يرمز غالباً، لثنائي القطب بالرمز à، حيث يدل السهم على الاتجاه من الشحنة الموجبة الى الشحنة السالبة. ويملك الجزيء، عزم ثنائي قطب، ..، وهو يساوي حاصل ضرب الشحنة e بالمسافة d، التي تفصل بين مركزي الشحنتين:
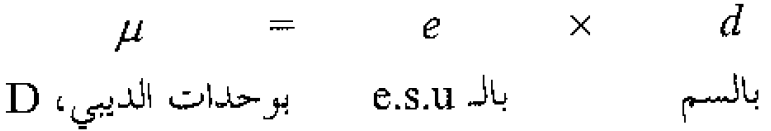
يمكن قياس عزم ثنائي القطب لجزيء، بطريقة لا مجال لذكرها هنا، وقد أوردنا في الجدول (1.1) بعض قيم عزوم ثنائيات القطب التي حصل عليها وفق تلك الطريقة. سوف نهتم بقيم عزوم ثنائيات القطب بصفتها مؤشرات على القطبية النسبية لمختلف الجزيئات.
الجدول 1.1: عزوم ثنائي قطب D

إن حقيقة كون بعض الجزيئات قطبية هي التي قادت الى الاعتقاد بأن بعض الروابط قطبية. لقد تناولنا مسألة قطبية الرابطة ببساطة في البداية لأنه لم يكن من المناسب الاعتقاد أن قطبية الجزيء هي مزيج من قطبيات الروابط المفردة.
إن جزيئات مثل، Br2 , Cl2 , O2 , H2 تملك عزم ثنائي قطب يساوي الصفر، أي أنها ليست قطبية. إن لكلا الذرتين المتماثلتين في كل جزيء من هذه الجزيئات، بالطبع، نفس الكهرسلبية، وبالتالي تتشاركان بالالكترونات بالتساوي؛ ولذلك عندما تكون (e) مساوية الصفر، يكون (u) مساوياً الصفر أيضاً.
ويملك جزيء مثل فلوريد الهيدروجين عزم ثنائي قطب كبير (D 1.75). ورغم أن جزيء فلوريد الهيدروجين صغير، إلا أن الكهرسلبية العالية لذرية الفلور تجذب الالكترونات بقوة، فعلى الرغم من أن المسافة (d) صغيرة، فإن الشحنة (e) كبيرة، ولذلك فإن العزم ) μ ( كبير.
يملك الميتان ورباعي كلوريد الكربون عزم ثنائي قطب معدوم. ونحن، يجب بالتأكيد أن نتوقع على الأقل بالنسبة لرباعي كلوريد الكربون. أن تكون الروابط فيه قطبية؛ ولكن بسبب البنية الرباعية الوجوه المتناظرة جداً فإن العزوم تفني بعضها تماماً (الشكل 1.1). أما في كلوريد المتيل CH3Cl فإن قطبية الرابطة كربون – كلور، لا تفني، وهكذا يملك كلوريد المتيل عزم ثنائي قطب مقداره (D 1.86). وهكذا فإن قطبية الجزيء لا تتعلق فقط بقطبية الروابط، بل أيضاً، بكيفية توجه تلك الروابط أي بهيئة أو شكل الجزيء.

الشكل 1.1: عزوم ثنائي القطب لبعض الجزيئات. قطبية الروابط والجزيئات.
تملك الأمونيا عزم ثنائي قطب مقداره (D 1.46). وهذا يمكن احتسابه بصفته عزم ثنائي القطب الصافي الناتج (جمع شعاعي) وعزوم الروابط الثلاث المفردة الموجهة كما هو موضح في المخطط التالي. وبنفس الطريقة يمكن حساب عزم ثنائي القطب للماء الذي مقداره (D 1.84).

الآن، ما هو نوع عزم ثنائي القطب الذي نتوقعه لجزيء ثلاثي فلوريد النتروجين، NF3، الذي يملك، مثل الأمونيا، بنية هرمية؟ إن الفلور هو العنصر الأكثر كهرسلبية من أي عنصر آخر، ولذا يجب أن يجذب الالكترونات من النتروجين، بقوة، وهكذا يجب أن تكون الرابطة N-F شديدة القطبية، وأن مجموعها الشماعي يجب أن يكون كبيراً – أكبر بكثير من الأمونيا ذات الروابط N-H المتواضعة القطبية.

ما هي الحقائق؟ يملك جزيء ثلاثي فلوريد النتروجين عزم ثنائي قطب مقداره (D 0.24). وهو ليس أكبر من عزم الأمونيا بل إنه أصغر بكثير.
كيف لنا أن نفسر ذلك؟ لقد نسينا زوجي الالكترونات غير المشترك بهما. والموجودين في NF3 (كما في NH3)، يشغل هذان الزوجان مداراً من نوع sp3 ويجب أن يسهم بعزم ثنائي قطب في الاتجاه المعاكس لمحصلة عزوم ثنائي قطب الروابط N-F، (الشكل 2.1). من الواضح أن هذه العزوم المتعاكسة لها نفس القيمة تقريباً، والنتيجة هي عزم صغير القيمة، دون أن نستطيع تحديد الاتجاه. وربما يرجع العزم الملاحظ في الأمونيا، بصورة رئيسية، الى زوجي الالكترونات غير المشترك بها في العزم الكلي للماء، وفي الواقع في أي جزيء يحتوي على مثل هذه الهيئة.
يمكن أن يقدم، عزم ثنائي القطب، معلومات قيمة عن بنية الجزيئات. فمثلاً، يمكن استبعاد أي بنية لرباعي كلوريد الكربون تعطي جزيئاً قطبياً، استناداً الى عزوم ثنائي القطب فقط. إن واقعة عزم ثنائي القطب، هذه، تدعم البنية الرباعية الوجوه لرباعي كلوريد الكربون. (ومع ذلك، فإنها لا تبرهن على صحة هذه البنية، لأن هناك بنى أخرى مقبولة يمكن أن تقود الى جزيء لا قطبي).
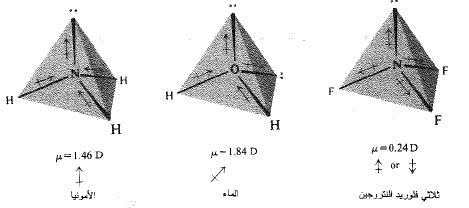
الشكل 2.1: عزوم ثنائي القطب لبعض الجزيئات. اسهامات الأزواج غير المشترك بها. في NF3 يعاكس العزم الناتج عن الزوجين غير المشترك بهما المجموع الشعاعي لعزوم الروابط.
مسألة .1 أي البنى التالية المقبولة لرباعي كلوريد الكربون تملك عزم ثنائي قطب يساوي الصفر؟ (أ) يقع الكربون في مركز مربع تحتل ذرات الكلور رؤوسه الأربعة. (ب) يقع الكربون في قمة هرم تحتل ذرات الكلور رؤوس القاعدة المربعة فيه.
مسألة 2. اقترح هيئة لجزيء CO2 يأخذ بالحسبان عزم ثنائي القطب لهذا الجزيء يساوي الصفر.
لم يقس عزم ثنائي القطب لمعظم المركبات، ويجري التنبؤ بقطبية هذه المركبات. فمن أجلها علينا توقع القطبية من البنية. إذ يمكن أن نقدر استناداً الى معلوماتنا عن الكهرسلبية، قطبية الروابط؛ ومن معرفتنا للقيم عن زوايا الترابط يمكننا تقدير قطبية الجزيئات، آخذين بالحسبان وجود أي زوجي الكترونات غير مشترك.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















