علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الازواج الاليكترونية غير المشتركة Unshared pairs of electrons
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 17 - 6th ed
31-10-2016
7080
الازواج الاليكترونية غير المشتركة Unshared pairs of electrons
يظهر المركبات المألوفان الأمونية و NH3، والماء H2O، كيف تؤثر زوج الالكترونات غير المشترك بها في البنية الجزيئية.

يشبه النتروجين في الأمونيا الكربون في الميتان؛ فتهجين النتروجين هو sp3، ولكن نرى من الجدول (1.1) أن النتروجين لا يملك سوى ثلاثة الكترونات غير متزاوجة، نحتل ثلاثة مدارات هجينة sp3. ويؤدي التراكب بين كل مدارم ن هذه المدارات الثلاثة مع مدار s لذرة هيدروجين، الى تشكيل الأمونيا (الشكل 1.1). أما المدار الرابع sp3 للنتروجين فيحتوي على زوجين من الالكترونات.
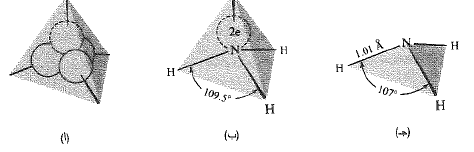
الشكل 1.1: تشكل رابطة: جزيء NH3. (أ) مدارات sp3 رباعي الوجوه. (ب) الشكل المتوقع، يظهر الزوجين غير المشترك بهما: تتوضع نوى H في تراكب أعظمي. (جـ) الشكل والحجم.
وإذا ما أريد تحقيق تراكب أعظمي أي تحقيق قوة ربط عظمي، يجب على نوى الهيدروجين التموضع في ثلاثة من رؤوس رباعي الوجوه الأربعة في حين الرأس الرابع يشغله زوجاً الالكترونات غير المشترك بهما. وإذا أخذنا بالحسبان النوى الذرية فقط، يمكننا أن نتوقع بنية الأمونيا على أنها على هيئة هرم يقع الآزوت عند القمة في حين تقع ذرات الهيدروجين عند الرؤوس الثلاثة للقاعدة المثلثية. ويجب أن تكون قيمة زاوية الترابط تساوي 107˚، أي أقل بقليل من القيمة المتنبأ بها؛ لقد اقتراح أن ذلك يرجع الى أن زوجي الالكترونات غير المشترك بهما يحتل حيزاً من الفراغ أكبر من الحيز الذي تحتله أي ذرة من ذرات الهيدروجين. وهكذا فإنهما (أي زوجي الالكترونات) يميلان الى ضغط زوايا الترابط قليلاً إن طول الرابطة نتروجين – هيدروجين يساوي A1.01، وتحتاج هذه الرابطة الى كمية من الطاقة قدرها 103 كيلو حريرة/مول كي تتحطم.
إن المدار sp3، المشغول بزوجي الالكترونات غير المشترك بهما، هو منطقة ذات كثافة الكترونية عالية، وإن هذه المنطقة تعد مصدراً للالكترونات بالنسبة للذرات والجزيئات الباحثة عن الالكترونات، وهذا ما يعطي الأمونيا صفاتها القاعدية.
هناك تشكيلان الكترونيان آخران ممكنان لجزيء الأمونيا، ولكن لا ينطبق أي منهما مع الواقع.
(أ) لما كان النتروجين يرتبط مع ثلاثة ذرات أخرى، كان من الممكن تصويره وفق التهجين sp2، كما هو الحال مع البور في ثلاثي فلوريد البور. غير أن الأمونيا ليس جزيئاً مستوياً، لذلك يجب رفض هذه الإمكانية. إن زوجي الالكترونات غير المشترك بهما في ذرة النتروجين هما ما يحدث الاختلاف بين NH3 و BF3، إذ من اللازم أن يبقى هذان الالكترونان بعيدين عن الالكترونات الموجودة في الروابط نتروجين – هيدروجين، ولا يحقق ذلك سوى الهيئة الرباعية الوجوه.
(ب) وكان من الممكن تصوير النتروجين مستخدماً المدارات p في عملية التراكب، لأنها تستطيع أن توفر
الالكترونات غير المتزاوجة الثلاثة اللازمة. ولكن هذا الأمر سيعود الى زاوية ترابط قيمتها 90˚ - لأن المدارات p متعامدة بعضها على بعض – وهذا مخالف لقيمة الزاوية المقيسة 107˚. والأكثر أهمية من ذلك كله هو أن على زوجي الالكترونات غير المشترك بهما البقاء في هذه الحالة في المدار is ونحن نعلم حقيقة من دراسات ثنائي القطب أن الأمر ليس كذلك في الواقع، فإن الربح الحاصل في الاستقرار والناجم عن استخدام المدارات sp3 العالية التوجه لتشكيل الروابط، أبكر مما يؤدي إليه رفع زوج الالكترونات غير المشترك بهما من المدار s الى المدار sp3 ذي الطاقة الأعلى.
وهناك حقيقة أخرى مرتبطة بالأمونيا: تكشف الدراسات الطيفية أن ذلك الجزيء يخضع لعملية قلب أو انقلاب inversion أي يخرج الداخل الى الخارج (شكل 2.1) هناك حاجز طاقة مقداره 6 كيلو حريرة/مول فقط، بين أحد الترتيبين الهرميين والترتيب الهرمي الآخر المكافئ له. تتوافر هذه الطاقة من تصادم الجزيئات، وحتى في درجة الحرارة الاعتيادية فإن مقدار الاصطدامات الحادثة توفر الطاقة الكافية للقيام بالمهمة ولذلك يحدث تحول سريع بين الترتيبين الهرميين.
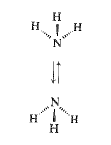
الشكل 2.1: انقلاب الأمونيا
لتقارن الأمونيا بالميتان الذي لا يعاني من مثل هذا الانقلاب: يقوم زوجا الالكترونات غير المشترك بهما بدور الرابطة كربون – هيدروجين في تعيين الشكل الأكثر استقراراً للجزيء أي الشكل رباعي الوجوه ولكن، وبشكل مخالف للرابطة كربون – هيدروجين، لا يستطيع زوجا الالكترونات غير المشترك بهما، إبقاء ترتيب رباعي وجوه معين مستمراً لأن الزوجين يتجهان في لحظة معينة في اتجاه ما، ولا يلبثان أن يتجها في الاتجاه المعاكس في اللحظة التالية.
وأخيراً لندرس جزيء الماء H2O يشبه الأمر هنا وجدناه في الأمونيا. فيما عدا أن الأكسجين يملك هنا شفعين من الالكترونات غير المشترك بها، وعليه فإنه يرتبط فقط بذرتي هيدروجين تقعان عند رأس من رؤوس رباعي الوجوه.
في حين ينشغل الرأسان الآخران من رباعي الوجوه زوجين من الالكترونات غير المشترك بهما، (شكل 3.1).

الشكل 3.1: جزيء H2O. (أ) مدارات sp3 رباعية الوجوه. (ب) الهيئة المتوقعة، تظهر الزوجان غير المشترك بهما. تتموضع نوى H في تراكب أعظمي. (جـ) الشكل والحجم.
وكما تدل القياسات فإن الزاوية H-O-H تساوي 105˚، أصغر من الزاوية المحسوبة لرباعي الوجوه، وكذلك أصغر من الزاوية الموافقة للأمونيا. إذ يوجد هنا زوجان من الالكترونات غير المشترك بهما يضغطان زوايا الترابط. ويبلغ طول الرابطة أكسجين 0 هيدروجين A 0.96، ويلزمنا 118 كيلو حريرة/مول لتحطيم إحدى روابط الماء.
إذا تفحصنا الشكل (4.1) نستطيع أن نرى تشابهاً قاعدياً بين جزيئات الميتان والأمونياً، والماء: تشابهاً ينبثق استناداً لمقارتنا التي استخدمناها عن التشابه في الترابط. ونرى أنه بسبب زوج الالكترونات غير المشترك بها في الأكسجين، فإن الماء قاعدة رغم أنه أقل قاعدية من الأمونيا

الشكل 4.1: (أ) الميتان، (ب) الأمونيا، (جـ) الماء.
مسألة 4.1 ماذا تتوقع أن تكون هيئة كل من الجزيئات التالية، واشرح كيف وصلت الى توقعاتك: (أ) أيون الأمونيوم NH4+. (ب) أيون الهيدرونيوم H3o+. (جـ) الكحول المتيلي CH3OH. (د) المتيل أمين CH3NH2.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)