
قانون الغاز المثالي
 المؤلف:
فريدريك بوش ، دافيد جيرد
المؤلف:
فريدريك بوش ، دافيد جيرد
 المصدر:
اساسيات الفيزياء
المصدر:
اساسيات الفيزياء
 الجزء والصفحة:
ص 377
الجزء والصفحة:
ص 377
 3-7-2016
3-7-2016
 11894
11894
قانون الغاز المثالي
لفهم طبيعة درجة الحرارة كخاصية فيزيائية اهتم بعض الباحثين الاوائل بدراسة كيفية تغير ضغط الغاز مع درجة الحرارة. وقد أجريت التجارب الحاسمة في هذا المجال من قرون عديدة، وما زال الطلاب يقومون بإجراء هذه التجارب الأساسية في مختبراتهم حتى اليوم . ويمثل؛ الشكل (1) تجهيزه معملية بسيطة لمثل هذا الغرض. وهنا يقاس ضغط الغاز كدالة في درجة الحرارة عند ثبوت حجم الغاز. وعند تمثيل نتائج مثل هذه التجربة بيانياً سوف نحصل على منحنيا ت كالمبينة بالشكل 2)).
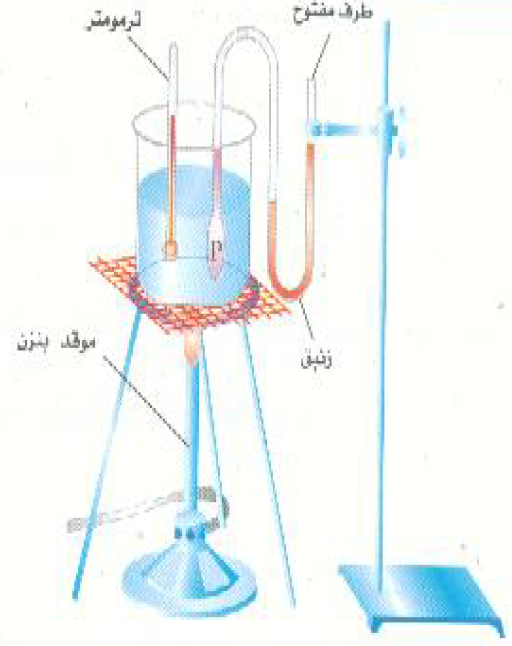
الشكل ((1: جهاز بسيط لقياس تأثير درجة الحرارة على ضغط الغاز عند ثبوت حجمه.
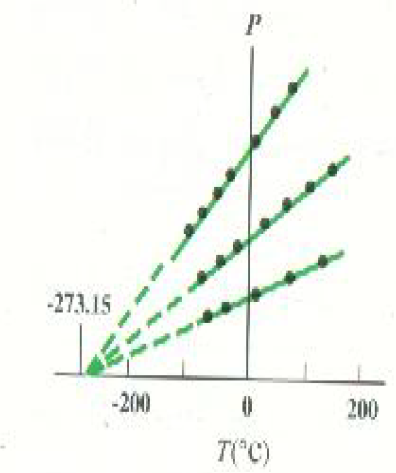
الشكل 2)): يقل ضفة الغاز غير الكثيف بانخفاض درجة الحرارة عند ثبوت الحجم (قانون جاي ــ لوساك). المنحنيات الثلاثة تنتمي إلى نقس الغاز، ولكن كمية الغاز في الحجم الثابت مختلفة.
واضح من الشكل ان هناك علاقة خطية بين الضغط المطلق ( مدلول ضغط المقياس زائد P0 ) ودرجة الحرارة، ملا ملاحظة أن الخطوط المستقيمة المختلفة تناظر شروطاً ابتدائية مختلفة للغاز داخل الوعاء. ومع ذلك يلاحظ في جميع الحلات وجود علاقة خطية بين درجة الحرارة والضغط عند ثبوت الحجم، بشرط أن يكون الغاز بعيداً عن شروط التكثف أو الإسالة.
التجربة الهامة الأخرى هي قياس حجم غاز كدالة في درجة حرارته مع حفظ ضغطه ثابتاً. ويمثل الشكل 3)) الرسم البياني النمطي للحجم مقابل درجة الحرارة. وهنا أيضاً توجد علاقة خطية: يزداد الحجم خطياً مع دراجة الحرارة عند ثبوت الضغط. ومرة ثانية، هذا صحيح طالما كان الغاز بعيداً عن شروط إسالته.
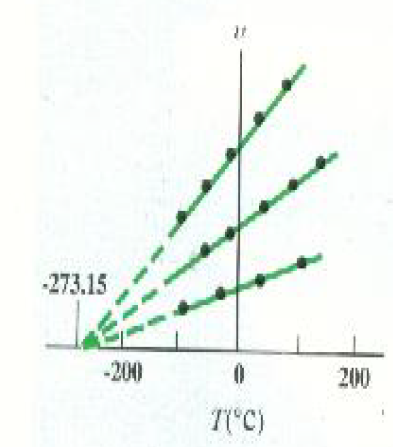
الشكل3) ): يتغير حجم الغاز الكثيف خطياً مع درجة الحرارة عند ثبوت P (قانون شارل). المنحنيات الثلاثة تنتمي إلى نفس الغاز، ولكن عند ضغوط مختلفة.
هناك كذلك سمة هامة أخرى يوضحها الشكلان 2)) و 3)) تتلاقى امتدادات جميع الخطوط المستقيمة عند نفس درجة الحرارة وهي -273.15oC .يمكن تمثيل العلاقتين التجربتين السابقتين رياضياً كما يأتي :
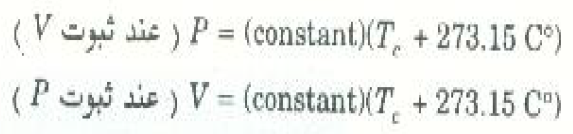
ويجب أن نؤكد هنا أن السلوك الذي تمثله المعادلتان السابقتان ينطبق على أي غاز مثالي. ولاحظ من هاتين المعادلتين أن P او V يصل إلى الصفر عندما Tc =-273.15oC وتعرف درجة الحرارة الفريدة التي يحدق عندها ذلك بالصفر المطلق، وهي تمثل أساس مقياس كلفن لدرجة الحرارة. ولكن الحصول على نتائج عملية بالقرب من الصفر المطلق أمر مستحيل بالنسبة لمعظم الغازات وذلك لنها تتكثف وتتحول إلى الحالة السائلة عند درجات حرارة أعلى من هذه بكثير. ومع ذلك فإن وجود درجة الحرارة الفريدة هذه يرجح أن لها أهمية أساسية من نوع ما ، وهذا ما سوف نناقشه بتفصيل أكثر فيما بعد.
وأخيراً تبين سلسلة أخرى من التجارب أنه عند ثبوت T وتغيير P أو V فإن حاصل الضرب PV يظل ثابتاً طبقاً للمعادلة الآتية:
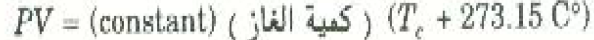
ويمكنك ان تتحقق بنفسك ان هذه المعادلة تنفق مع المعادلتين الأخريين . تقاس كمية الغاز في العينة عادة بعدد المولات n الذي يعطي بالعلاقة:
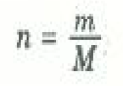
حيث m كتلة عينة الغاز، M الكتلة الذرية أو الجزيئية للغاز. أما الثابت في معادلة PV السابقة فهو أحد الثوابت الفيزيائية العامة الذي يجب أن تعين قيمته عملياً. هذا الثابت يسمى ثابت الغازات ويرمز له دائماً بالرمز R. وباستعمال جميع الرموز السابقة في معادلة PV نحصل على:
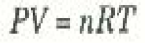
حيث T هي درجة الحرارة المطلقة: T = Tc + 273.15oC.
العلاقة السابقة تسمى قانون الغاز المثالي، وتسمى الغازات التي تتبع هذا القانون بالغازات المثالية. وقد وجد أن جميع الغازات تسلك هذا السلوك المثالي طالما كانت بعيدة عن الظروف التي يحدق عندها تكثف الغاز وتحوله إلى الحالة السائلة. هذا وقد اثبتت القياسات العملية المتكررة أن قيمة R بالوحدات SI هي:
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


