
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
الروابط الفيزيائية: قوى فان دير فال Van der Waals forces))
المؤلف:
أ.د. محمود محمد سليم صالح
المصدر:
تقنية النانو وعصر علمي جديد
الجزء والصفحة:
ص31–32
2023-07-22
3535
ترتبط جزيئات المركبات التساهمية غير القطبية ببعضها بعضًا بروابط فيزيائية ضعيفة جدًّا، وتكون ناتجة من تجاذب أنوية الذرات في جزيء معين مع إلكترونات التكافؤ في جزيء مجاور، ويطلق على هذه القوى: روابط فان دير فال (انظر الشكل رقم 13).
ومثال ذلك: ارتباط جزيئات الهالوجينات في حالتها العنصرية بروابط فان دير فال، حيث نجد أنه بمجرد نزولنا إلى أسفل المجموعة من الفلور إلى اليود (انظر: الجدول الدوري للعناصر) تزداد قوة روابط فان دير فال بسبب ازدياد العدد الذري (عدد البروتونات في الأنوية، وعدد الإلكترونات في مستويات الطاقة الإلكترونية)؛ لذلك نجد أنه كلما نزلنا إلى أسفل المجموعة تزداد كثافة الهالوجين، كما تزداد درجة غليانه، وانصهاره. وهناك عامل آخر يسبب هذه الزيادة، وهو ازدياد الوزن الجزيئي بنزولنا إلى أسفل مجموعة الهالوجينات، ففي الوقت الذي يظهر الفلور غازًا خفيفا نجد الكلور غازا أثقل منه، والبروم سائلاً، واليود مادة صلبة (4).
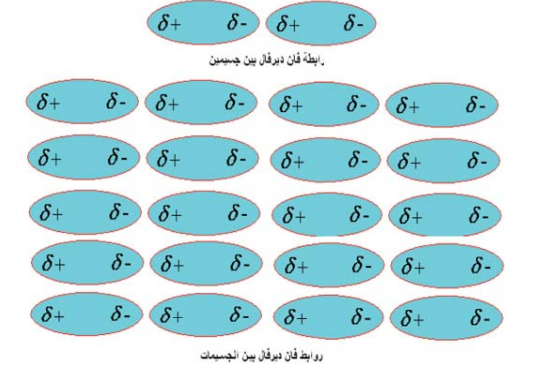
شكل رقم (13) رسم توضيحي لرابطة فان دير فال بين جسمين فأكثر (4).
__________________________________________________
هوامش
(4) Kohler, M. and Fritzsche, W. Nanotechnology: An Introduction to Nano structuring Techniques, Wiley- VCH Second, Completely Revised Edition, 2007.
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















