


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
أقرأ أيضاً
التاريخ: 23-8-2021
التاريخ: 29-12-2021
التاريخ: 2025-01-25
التاريخ: 28-12-2021
|
وهو واحد من أهم البروتينات الصباغية المعدنية الهيمية يوجد في الأنسجة العضلية الحمراء حيث يقوم بتخزين الأكسجين ليُحَرِّره لاحقاً في حالات نقص الأكسجين (كما في حال التمارين المجهدة) لتستخدمه متقدرات العضلات في عملية تصنيع الطاقة ATP المعتمدة على الأكسجين. يتكون الميوغلوبين من سلسلة ببتيدية واحدة تتألف من 153 ثمالة حمضية أمينية تتوزع فراغياً بشكل تتوضع فيه الثمالات القطبية على سطح الجزيء والثمالات غير القطبية في لبه، وهذا ما يميز البروتينات الكروية. أما الثمالات التي تحوي مناطق قطبية وأخرى غير قطبية معاً مثل الثريونين والتربتوفان والتيروزين) فتتوجه مناطقها غير القطبية نحو الداخل. وفيما عدا ثمالتي الهيستيدين اللتين تساهمان في ارتباط الأكسجين، فإنّ لُبَّ الميوغلوبين يحوي ثمالات غير قطبية فقط (كاللوسين والفالين وفينيل الألانين). والميوغلوبين جزيء مكتتر كروي تقريباً (الشكل 1) غني بالبنى الحلزونية ألفا مع بعض الصحائف بيتا والعرا. تُرقم هذه البنى المختلفة أو يُشار إليها بأحرف بدءاً من نهايته الأمينية. يوجد نحو %75 من الثمالات في ثمانية حلزونات ألفا يمينية الاتجاه تتراوح أطوالها بين 7 و20 ثمالة وتُدعى، بدءاً من النهاية الأمينية، بالحلزونات من A إلى H . تُميَّز المناطق بين الحلزونات بأحرف الحلزونين المرتبطين بها (فمثلا تقع المنطقة CD بين الحلزون C والحلزون (D). ويُرمزلثمالة ما بحرف يشير إلى توضعها (الحلزون أو المنطقة بين حلزونين) ورقم يشير إلى ترتيبه بدءا من النهاية الأمينية لهذا الحلزون؛ فمثلاً، يشير الرمز HisF8 إلى الثمالة الثامنة في الحلزون F (93 في الجزيء)، وهي الهيستيدين. وقد تكون الثمالات المتباعدة في البنية الأولية (في حلزونات مختلفة مثلا) متقاربة جداً فراغياً كما هو حال الهيستيدين الداني proximal ورمزه HisF8)) والهيستيدين القاصي distal (رمزه HisE7 64في الجزيء) (الشكل1).
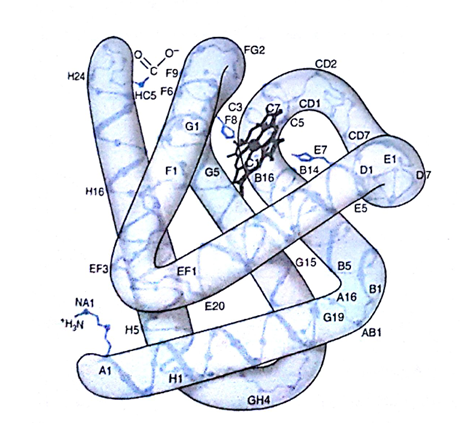
شكل (1) نموذج لبنية الميوغلوبين . لاحظ موقع حلقة الهيم ( باللون الرمادي ) ومستواها ومستوى ذرة الحديد ( في الوسط) وموقع الهيستيدين الداني ( F8) والقاصي ( E7)
والهيم في الميوغلوبين (وكذلك في الهيموغلوبين) هو عبارة عن حديدي البروتوبورفيرين III (أو IX) تتوضع فيه ذرة الحديد خارج مستوي الجزيء، لأنها أكبر مــــن الحيز بين هذه الذرات. ترتبط ذرة الحديدي (Fe+2) (أو الحديدوز (ferrous) بروابط تعاونية (أو تشاركية coordinated) مع ذرات نتروجين حلقات البيرول الأربع وترتبط بالسلسلة الببتيدية للوحيدة عبر رابطة تعاونية مع الهيستيدين الداني (His F8 )
تقوم ثمالتا الهيستيدين (F8) وE7) بدور فريد في عمل الميوغلوبين (والهيموغلوبين). يوجه هيم الميوغلوبين المتوضع ضمن فجوة بين الحلزونين E و F) (الشكل 1 )مجموعاته البروبيونية القطبية إلى السطح، أما الباقي فيتوجه إلى داخل جزيء الميوغلوبين حيث تكون الثمالات الأمينية المحيطة كلها غير قطبية باستثناء His F8 و His E7 . ويرتبط الموضع التشاركي coordination الخامس للحديدي بالنتروجين الحلقي للهيستيدين الداني. وفي حين لا يرتبط الهيستيدين القاصي موضع بموضع التشارك السادس للحديدي، فإنه يتوضع على جانب حلقة الهيم المقابل للثمالة ويلعب دوراً كبيراً في أكسدة حديد الهيم وارتباط بعض كبيراً في منع الغازات السامة كأول أكسيد الكربون.
يتوضع حديد الهيم في الميوغلوبين غير المؤكسج خارج مستوى الحلقة باتجاه الهيستيدين F8 وعلى بعد 0.3 أنغستروم عنها؛ أما في الميوغلوبين المؤكسج فيشغل الأكسجين الموضع التشاركي السادس لذرة الحديدي مما يجعله يبعــــد نحو 0.1 أنغستروم فقط خارج مستوي الهيم. وهذا يعني أن الأكسجة تترافق مع تحرك ذرة الحديد يعني باتجاه مستوى الحلقة ساحبة معها ثمالة HisF8 والثمالات الأخرى المرتبطة بما تساهميا (الشكل 2). هذه الحركة تؤدي إلى إحداث هيئة فراغية جديدة لأجزاء البروتين.
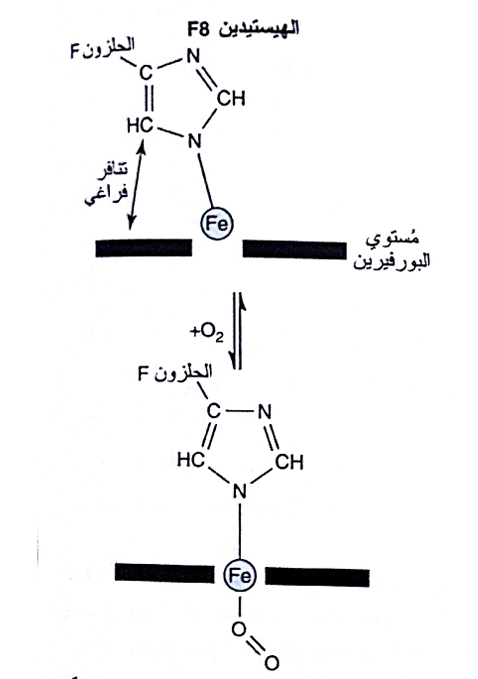
شكل (2) حركة الحديد نحو مستوى الحلقة الهيم عند اكسجته
يؤمن الميوغلوبين (والهيموغلوبين) بيئة تحمــي حديد الهيم فعند ارتباط جزيء الأكسجين بالميوغلوبين تتعامد الرابطة بين ذرة الأكسجين الأولى والحديدي مع مستوي حلقة الهيم، أما ذرة الأكسجين الثانية فترتبط بزاوية 120 درجة مئوية
الهيم عند أكسبته.
مع مستوي الهيم وتتوجه بعيداً عن الهيستيدين القاصي His E7 (الشكل3 (أ، د)). يرتبط أول أكسيد الكربون (CO) مع الهيم الحر أقوى بنحو 25.000 مرة من الأكسجين، ومع ذلك فهو لا يشغل موضع التشارك السادس من حديد الهيم. والسبب هو الإعاقة التي يفرضها البروتين حول الهيم، فالتوجه المفضل لارتباط CO بحديد الهيم هو أن تكون الرابطة بين الذرات الثلاث (C ،Fe، 0) عمودية على حلقة الهيم. وهذا ممكن في الهيم الحرّ (الشكل 3 (ب))، أما في الميوغلوبين فالهيستيدين القاصي يعيق فراغياً ارتباط CO بهذه الزاوية الشكل 3 (ج)) مما يُجبره على الارتباط بشكل فراغي أقل استقراراً ويخفف من قوة ارتباطه بالهيم بأكثر من الضعفين. ومع ذلك، يرتبط CO بنحو 1% من الميوغلوبين السوي، فرغم الإعاقة تبقى قوة ارتباط CO بالميوغلوبين أكبر بنحو 200 مرة من قوة ارتباط O2 ولكن تبقى نسبة ارتباطه أقل بكثير من ارتباط الأكسجين في الأحوال السوية.
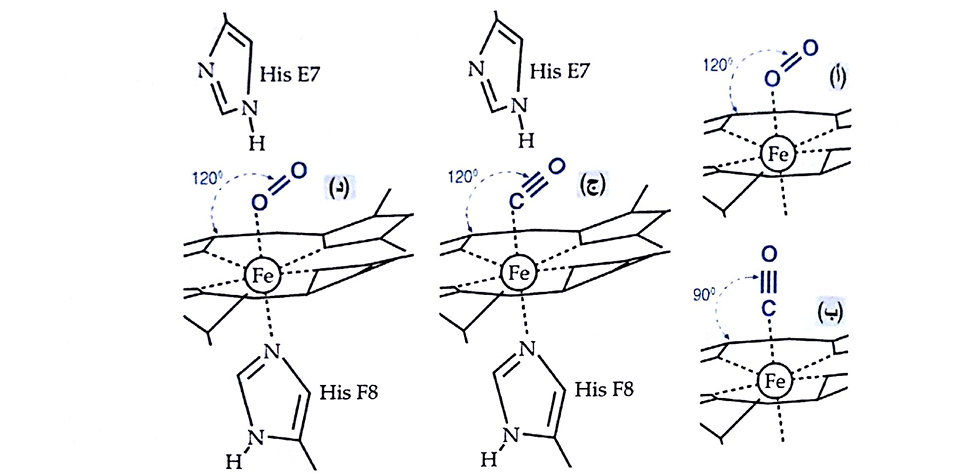
شكل(3) زوايا استقرار ارتباط الهيم الحر بالاكسجين (أ) وأول أوكسيد الكاربزن (ب) والزوايا الممكنة التي يفرضها وجود الهيم ضمن الميوغلوبين ودور الهيستيدين القاصي ( E7) (ج,د)
لماذا يكون الميوغلوبين فعالاً في تخزبن الاكسجين ولكنه غير قادر على نقله ؟
تعتمد كمية الاكسجين المرتبطة بالميوغلوبين والمعبر عنها بالتشبع المئوي ( Percent saturation) على تركيز الأكسجين (المعبر عنه بالضغط الجزئي للأكسجين partial pressure Po2 في البيئة المحيطة مباشرة بحديـــد الهـيـم.
يمكن التعبير عن العلاقة بــين PO2 وكمية الأكسجين المرتبطة بالحديد بيانياً بمنحني تشبع الأكسجين (أو منحني تفارق
الاوكسجين oxygen dissociation. يكون شكل هذا المنحني في الميوغلوبين زائدي المقطع hyperbolic. وبما أن الضغط الجزئي للأكسجين PO2 في السرير الشعري الرئوي يبلغ 100 مم زئبق، فإنه يمكن تحميل الميوغلوبين بالأكسجين في الرئة. بيد أن هذا الضغط يبلغ في الدم الوريدي 40 مم زئبق، وفي العضلات الحركية نحو 20 مم زئبق فقط. وبما أن الميوغلوبين لا يستطيع أن يُسلّم جزءاً كبيراً من الأكسجين المرتبط به، ولا حتى عند مستوى 20 مم زئبق، لذلك فإنه لا يستطع أن يكون وسيلة فعالة لنقل الأكسجين من الرئتين إلى الأنسجة المحيطية. إن نقص الأكسجين الذي يترافق مع التمارين البدنية المجهدة يمكن أن يصل بقيمة الضغط الجزئي للأكسجين في الأنسجة العضلية إلى مستوى يبلغ نحو 5 مم زئبق. وعند هذا المستوى، يُحرر الميوغلوبين الأكسجين المرتبط به لتستخدمه المتقدرات العضلية في تصنيع الطاقة ATP وهذا ما يجعل وظيفته تقتصر على خزن الأكسجين في العضلات وليس نقله بين الأنسجة على عكس الهيموغلوبين.

|
|
|
|
للعاملين في الليل.. حيلة صحية تجنبكم خطر هذا النوع من العمل
|
|
|
|
|
|
|
"ناسا" تحتفي برائد الفضاء السوفياتي يوري غاغارين
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|