
التفاعلات الجزيئية
 المؤلف:
بيتر أتكينز
المؤلف:
بيتر أتكينز
 المصدر:
الكيمياء الفيزيائية
المصدر:
الكيمياء الفيزيائية
 الجزء والصفحة:
ص 51 – ص 54
الجزء والصفحة:
ص 51 – ص 54
 2024-10-01
2024-10-01
 1579
1579
يستعين علماء الكيمياء الفيزيائية بالديناميكا الحرارية الإحصائية لفهم تركيب نواتج التفاعلات الكيميائية التي وصلت إلى حالة الاتزان. ويجب أن نتذكر ما جاء في الفصل الثاني من أن التفاعلات الكيميائية تبدو وكأنها تتوقف قبل استنزاف جميع المواد المتفاعلة. وهذا يعني أنها تصل إلى حالة الاتزان وهي حالة تستمر فيها التفاعلات الأمامية والعكسية، ولكن بمعدلات متطابقة بحيث لا يكون هناك تغير إجمالي في التركيب. ما الذي يحدث هنا؟ وكيف ينظر علماء الكيمياء الفيزيائية إلى حالة الاتزان على المستوى الجزيئي؟
في الفصل الثاني، ذكرتُ أن علماء الكيمياء الفيزيائية يعرفون حالة الاتزان بالبحث عن التركيب الذي تصل طاقة جيبس عنده إلى أدنى مستوى هذا، عند درجة حرارة وضغط ثابتين، يشير إلى التركيب الذي يسفر عنده أي تغيير إضافي أو تفاعله العكسي عن انخفاض في إجمالي الإنتروبي، ولذا يكون غير طبيعي. ونظرًا إلى أننا قد رأينا أن الديناميكا الحرارية الإحصائية قد تفسر إنتروبي المواد من خلال التعويل على البيانات البنيوية، فينبغي لنا أن نتوقع الاستعانة بمنطق مماثل للربط بين تراكيب الاتزان والبيانات البنيوية، كتلك المستقاة من التحليل الطيفي أو الحوسبة.
السبب الجزيئي وراء وصول التفاعلات الكيميائية إلى حالة الاتزان مثير جدًّا للاهتمام (حسبما أظن وتوضحه الديناميكا الحرارية الإحصائية لنأخذ تفاعلا كيميائيا فيزيائيا نموذجيًا وبسيطًا للغاية، A → B. يمكننا الاستعانة بالديناميكا الحرارية الإحصائية لحساب الإنثالبي والإنتروبي لكل من المادة المتفاعلة A والناتج B، وبالتالي يمكننا أن نستخدم هذه القيم لحساب طاقة جيبس الخاصة بهما من البيانات البنيوية. الآن، تخيل أن جميع الجزيئات الموجودة في المادة A تقيدت بأماكنها ولا يمكنها أن تنتقل من مواضعها المبدئية. وإذا تغيرت جزيئات المادة A بالتدريج إلى جزيئات المادة B، فإن إجمالي طاقة جيبس للنظام تتحرك في خط مستقيم يعكس وفرة النوعين، من قيمتها الخاصة بالمادة «A فقط إلى القيمة الخاصة بالمادة B فقط». وإذا كانت طاقة جيبس الخاصة بالمادة B أقل من تلك الخاصة بالمادة ، فسيكتمل التفاعل، نظرًا إلى أن المادة «B النقية» تتمتع بأدنى مستوى لطاقة جيبس في جميع المراحل الممكنة للتفاعل. وهذا ينطبق على جميع التفاعلات التي على الشاكلة نفسها، إذن عند هذه المرحلة علينا توقع أن أمثال تفاعل A → B هذا ستكتمل على نحو مثالي، وستتحول جميع المواد على شاكلة A إلى B. ولكن هذا لا يحدث من الناحية الواقعية.
إذن ما الذي نسيناه؟ تذكر أننا قلنا إن جميع جزيئات المادة A كانت مقيدة بأماكنها. وهذا غير صحيح من الناحية العملية، هذا لأنه من أجل أن تتحول المادة A إلى B، تختلط المادتان وعند مرحلة وسيطة من التفاعل يكون هناك مزيج مختلط على نحو عشوائي من المواد المتفاعلة والنواتج . يزيد الخلط من الاضطراب ويزيد إنتروبي النظام وبالتالي يقلل طاقة جيبس (تذكر أن G = H – TS ولاحظ علامة الناقص، وبالتالي فإن زيادة الإنتروبي s تقلل طاقة جيبس G.) تحدث الزيادة العظمى في الإنتروبي بسبب الخلط، وبالتالي فالانخفاض الأكبر في طاقة جيبس، عندما تكون المادتان A وB متساويتين من حيث الوفرة. وعند الأخذ في الاعتبار هذا الإسهام القائم على الخلط، ينتج عنه أدنى مستوى لإجمالي طاقة جيبس لتركيب وسيط بين المادة A النقية والمادة B النقية، وهذا الحد الأدنى يتوافق مع التركيب الذي يكون عنده التفاعل في حالة اتزان انظر شكل 3–2). ويمكن حساب طاقة جيبس للخليط بسهولة بالغة، ولقد رأينا بالفعل أن تغير طاقة جيبس ما بين المادة A النقية والمادة B النقية يمكن حسابه من البيانات البنيوية، إذن نحن لدينا طريقة لتفسير تركيب حالة الاتزان من البيانات البنيوية.
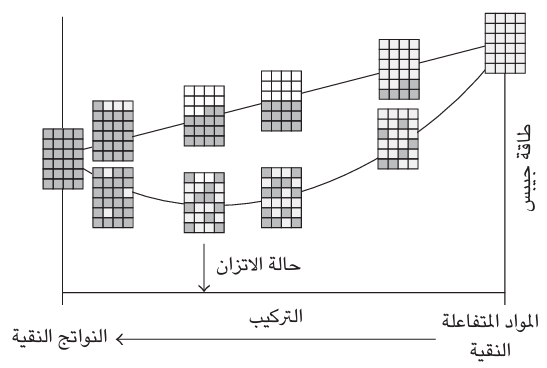
شكل 3–2: الدور الذي يلعبه الخلط في تحديد تركيب حالة الاتزان لخليط التفاعل. فعند غياب عملية الخلط، يسير التفاعل الكيميائي نحو الاكتمال؛ ولكن عند الوضع في الاعتبار خلط المواد المتفاعلة والنواتج ، يتحقق الاتزان عند وجود كليهما.
يستعين علماء الكيمياء الفيزيائية بمنطق مشابه لتفسير تأثير الظروف المتغيرة على تركيب حالة الاتزان. وكما ذكرت في الفصل الثاني، تعتمد العمليات الصناعية، فيما يتعلق بإمكانية وصولها إلى حالة الاتزان (والتي تكون غير ممكنة في الكثير من الأحيان)، على الاختيار الأمثل للظروف. وتتيح الديناميكا الحرارية الإحصائية، وذلك من خلال توزيع بولتزمان واعتماده على درجة الحرارة، لعلماء الكيمياء الفيزيائية فهم السبب في بعض الحالات وراء تفضيل حالة الاتزان لتكوين المواد المتفاعلة (وهو أمر غير مرغوب غالبًا) أو النواتج (وهو أمر مرغوب فيه دائمًا) عندما ترتفع درجة الحرارة. قدم أونري لو شاتلييه (1850–1936) قاعدة عامة في عام 1884، رغم أنها لم تكن رؤية متبصرة بشكل كبير، تفيد بأن النظام في حالة الاتزان يستجيب إلى الاضطراب من خلال ميله لمعاكسة تأثيره. وبالتالي، إذا أطلق تفاعل ما طاقة على هيئة حرارة (بمعنى أنه تفاعل «طارد للحرارة»)،
فإن رفع درجة الحرارة سيعاكس تكوين المزيد من النواتج أما إذا كان التفاعل يمتص طاقة على هيئة حرارة (بمعنى أنه تفاعل ماص للحرارة»)، فإن رفع درجة الحرارة سيشجع تكوين المزيد من النواتج.
مثلث إحدى نتائج مبدأ لو شاتلييه إحدى المشكلات التي واجهت الكيميائي فريتس هابر (1868–1934) والمهندس الكيميائي كارل بوش ( 1874–1940) في مسعاهما للبحث عن طرق لتصنيع الأمونيا بطريقة عملية اقتصاديًا في أوائل القرن العشرين. كانا يعرفان أن رفع درجة حرارة خليط التفاعل الخاص بهما بين النيتروجين والهيدروجين يعاكس تكوين الأمونيا، نظرًا إلى أنه تفاعل طارد للحرارة، وهو ما كان لا يرغبانه بكل بساطة. وأرغمهما هذا الإدراك على البحث عن عامل محفز من شأنه أن ييسر العملية عند درجة حرارة معتدلة وليست مرتفعة جدًّا.
تقدم الديناميكا الحرارية الإحصائية تفسيرًا لمبدأ لو شاتلييه (ما زالت أركز على دورها في تفسير تأثير درجة الحرارة؛ حيث يمكن لتأثيرات أخرى أن يكون لها دور ويمكن تفسيرها.) إذا كان التفاعل طاردًا للحرارة، إذن فإن مستويات الطاقة الخاصة بالنواتج تكون أدنى من مستويات الطاقة الخاصة بالمواد المتفاعلة. وفي حالة الاتزان، تتوزع الجزيئات على جميع الحالات المتاحة وفقًا لتوزيع بولتزمان، فإذا كان جزيء في حالة طاقة مرتبطة بـ «المواد المتفاعلة» فإنه يكون جزءًا من المواد المتفاعلة، وإذا كان في حالة طاقة مرتبطة بـ «النواتج»، فإنه يكون جزءًا من النواتج. وعند رفع درجة الحرارة، يمتد توزيع بولتزمان لأعلى أكثر إلى حالات الطاقة العالية الخاصة بالمواد المتفاعلة، ومن ثُم يصبح عدد أكبر من الجزيئات جزءًا من المواد المتفاعلة (انظر شكل 3–3)، كما يتوقع مبدأ لو شاتلييه تمامًا. وينطبق المنطق نفسه على التفاعل الماص للحرارة، عندما تكون حالات طاقة «النواتج» أعلى حالات طاقة «المواد المتفاعلة» ويزداد عدد الجزيئات فيها عند رفع درجة الحرارة، وهو ما يكافئ التشجيع على تكوين النواتج.
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


