

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
نزع هاليد الهيدروجين من هاليدات الالكيل : الحذف – 1 ، 2.
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 313
20-3-2017
13853
نزع هاليد الهيدروجين من هاليدات الالكيل : الحذف – 1 ، 2.
Dehydrohalogenation of alkyl halides: 1, 2- elimination
عندما يعالج بروميد ايزو البروبيل بمحلول كحولي ساخن لأساس قوي* مثل هيدروكسيد البوتاسيوم نحصل على البروبيلين وبروميد البوتاسيوم والماء.
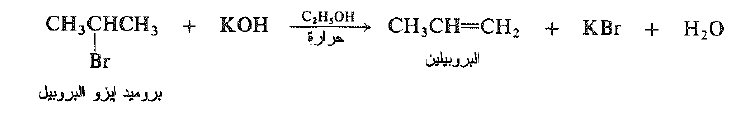
يعد هذا التفاعل مثالاً على نزع هاليد الهيدروجين . وهو حذف 1- ، 2 لعناصر هاليد الهيدروجين. يتضمن نزع هاليد الهيدروجين فقدان – حذف – ذرة الهالوجين وذرة هيدروجين من ذرة كربون مجاورة للذرة التي تفقد الهالوجين ، إن الكاشف اللازم هو أساس ، وظيفته سبح الهيدروجين على شكل بروتون.
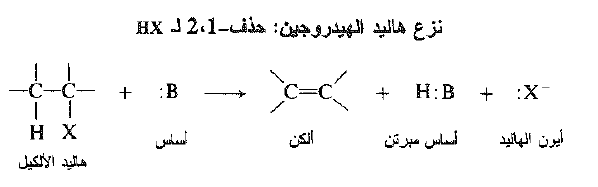
الأساس B : يمكن أن يكون معتدلاً أو مشحوناً سلبياً، مثلاً H2O أو OH- والحمض الموافق H:B يمكن أن يكون مشحوناً إيجابياً او معتدلاً مثلاً H3O+ أو H2O.
والآن كيف يولد تفاعل الحذف رابطة مزدوجة؟ بغض النظر عن الآلية الفعلية: حيث تظهر منتجات التفاعل وما يحدث هو التالي: يغادر الهالوجين الجزيء على شكل أيون هاليد وبالتالي بأخذ معه شفعه الالكتروني . يجرد الهيدروجين بالأساس على شكل بروتون تاركاً خلفه شفع الألكترونات ، وهذا الشفع* من الالكترونات هو المتوافر لتشكيل الرابطة الثانية – الرابطة π - بين ذرتي الكربون.
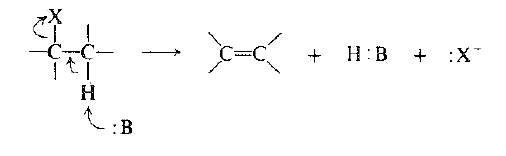
نسمي التفاعل الحذف 1- ، 2 : لأن تشكل الرابطة المزدوجة يجب ان يتأتي من انفصال الهيدروجين المرتبط بذرة الكربون المجاورة لذرة الكربون المرتبطة مع الهالوجين. وتدعى ذرة الكربون التي يتثبت عليها الهالوجين عموماً بذرة الكربون α- (الكربون – ألفاً).
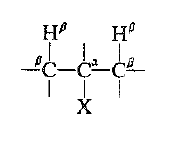
وتدعى كل ذرة كربون مرتبطة بالكربون α- الكربون – β (كربون بيتا) وتدعى ذرات الهيدروجين المرتبطة بها بالهيدروجين B- ويتعين تفاعل الحذف عندئذ فقدن هيدروجين β -.
في بعض الأحيان، ينتج عن تفاعل نزع هاليد الهيدروجين الكناً وحيداً ، وفي حالات اخرى ينتج مزيجاً، ولتوقع اي المنتجات يمكن أن تتشكل في تفاعل، يجب علينا فقط فحص بنية الركيزة. يمكننا توقع شكل الالكن الموافق لفقدان اي ذرة من ذرات الهيدروجين β- ولكن ليس اي الكنات اخرى. مثلاً، يستطيع أن يفقد بروميد نظامي البوتيل الهيدروجين من C-2 فقط ويتشكل الناتج -1 البوتن فقط.
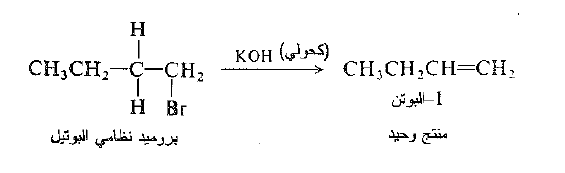
من ناحية اخرى يفقط بروميد ثانوي البوتيل الهيدروجين من C-1.
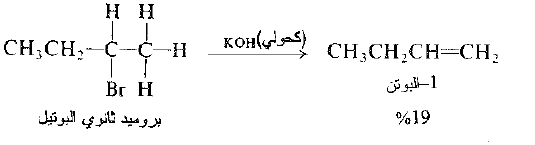
ومن C – 3
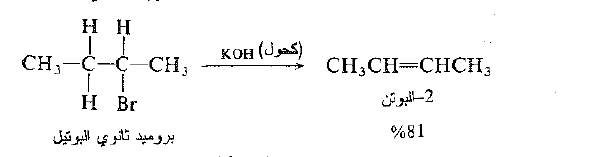
وبالتالي يتشكل كل من -1 البوتن و -2 البوتن. وعندما يتشكل الكنات يكون -2 البوتن هو المنتج الرئيس : تتوافق هذه النتيجة مع النمط العام لنزع هاليد الهيدروجين الذي سوف نناقشه لاحقاً.
يفترض ان ما ناقشناه حتى الآن عدم حصول إعادة ترتيب، وهذا الافتراض مقبول في تفاعلا نزع هاليد الهيدروجين الحاصلة في الشروط الاعتيادية: في محاليل كحولية مركزة لأساس قوي. يجب علينا ان نتعلم وندرك حالات إعادة الترتيب الممكنة، وتوقع منتجات الحذف في هذه الحالات ايضاً).
عند دراسة نزع هاليد الهيدروجين يجب علينا ان نتعلم الكثير بشأن كافة أنواع التفاعلات التي تتبع هذه العملية وأيها يعد نموذجاً للحذف 1- ، 2.
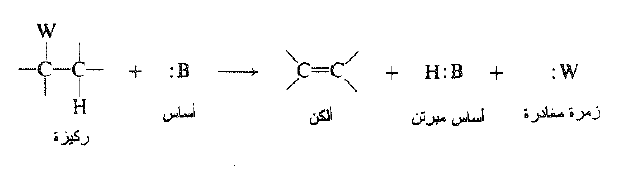
وتتصف تفاعلات الحذف هذه بما يلي:
(أ) تحتوي الركيزة زمرة مغادرة، وهي ذرة أو زمرة تغادر الجزيء آخذة معها شفعها الالكتروني.
(ب) تحتوي الركيزة في موضع β- بالنسبة للزمرة المغادرة على مجموعة أو ذرة هي في معظم الأحيان هيدروجين يمكن تجريده بأساس تاركاً خلفه شفعه الالكتروني.
(جـ) يحدث التفاعل بفعل الأساس.
يجب ان يكون الأساس نموذجاً أنيوناً قوي الأساسية مثل الهيدروكسيد أو الالكوكسيد مشتق من كحول أو ايتوكسيد – C2H2O او ثالثي البوتوكسيد (CH3)3 CO- .. الخ.
ولكن المذيب نفسه والذي هو مادة معتدلة مثل الكحول أو الماء يمكن ان يقوم في بعض الأحيان بدور الأساس على الرغم من انه ضعيف إلى حد بعيد.
من المفيد عملياً ان يرمز للمذيبات او الكواشف باختصار تسميات الزمر الالكينية البسيطة فيها: متيل Me ، اتيل Et ، نظامي بروبيل n – Pr ، ايزو بروبيل I – Pr ، ثالثي بوتيل t – Bu وبذلك يصبح الميتانول MeOH وميتوكسيد الصوديوم NaOme وأيون الميتوكسيد MeO-.
في تفاعلات الحذف تكون الزمرة المغادرة الجيدة انيوناً او جزيئاً ذا خواص أساسية ضعيفة كما في تفاعلات الاستبدال النوكليوفيلي ولنفس السبب تماماً. وتحرر الأسس الضعيفة البروتون بسهولة، مثلما تحرر الزمرة المغادرة الجيدة الكربون في تفاعلات الاستبدال تكون الزمرة المغادرة في نزع هاليد الهيدروجين أيون الهاليد ذي الأساسية الضعيفة ، وانه ليس مصادفة ان تكون هاليدات الالكيل ركائز مهمة في كلا تفاعلي الاستبدال النوكليوفيلي والحذف، ولا كذلك مصادفة، ان تختار بدائل هاليدات الالكيل لتستخدم في كلا النوعين من التفاعلات. هنالك ركائز اخرى – يمكنها ان تحرر أنيونات أساسية ضعيفة ومن بين هذه الركائز الرئيسية الاخرى السلفونات .
(إن التشابه في ركائز تفاعلات الاستبدال النوكليوفيلي والحذف يقترن مع حقيقة ان كلاً من النوكليوفيلات والأسس هي كواشف غنية بالالكترونات وبالتالي فإن الكاشف نفسه، وفي معظم الاحيان، يقود إلى مشاكل كامنة، هنالك دائماً تنافس بين هذين التفاعلين.
الآن، ما هي الآلية او الآليات التي يخضع لها تفاعل نزع هاليد الهيدروجين؟ عند تفحص بنى المواد المتفاعلة ومنتجات التفاعل – يمكننا أن نصل إلى بعض الاستنتاجات إلى ما يحدث اثناء التفاعل: هنالك روابط تنحطم وروابط اخرى تتشكل، ولكن ما هو الفاضل الزمني بين تحطم هذه الروابط وتشكل تلك؟ وكما هو معروف دائماً، فإن هذا السؤال يجب الإجابة عليه عندما يكون لدينا آلية.
*اساس : قاعدة
*شفع اليكتروني : زوج اليكتروني
 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















