

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
16-Electron square-planar compounds
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
636
2025-09-30
175
16-Electron square-planar compounds
Key point: With strong-field ligands, a square-planar complex has only eight bonding MOs, thus a 16-electron configuration is the most energetically favourable configuration. One other geometry already discussed in the context of coordination chemistry is the square-planar arrangement of four ligands (Section 20.1), where we noted that it occurred only for strong-field ligands and a d8 metal ion. Because organometallic ligands often produce a strong field, many square-planar organometallic compounds exist. Stable square planar complexes are normally found with a total of 16 valence electrons, which results in the population of all the bonding and none of the antibonding MOs (Fig. 22.2). The ligands in square-planar complexes can normally provide only two electrons each, for a total of eight electrons. Therefore, to reach 16 electrons, the metal ion must provide an additional eight electrons. As a result, organometallic compounds with 16 valence electrons are common only on the right of the d block, particularly in Groups 9 and 10 (Table 22.1). Examples of such complexes include [Ir(CO)Cl (PPh3 )2] (6) and the anion of Zeise’s salt, [Pt(C2H4) Cl3]- (1). Square-planar 16-electron complexes are particularly common for the heavier elements in Groups 9 and 10, especially for Rh(I), Ir(I), Pd (II), and Pt (II), because the ligand-field splitting is large and the ligand-field stabilization energy of these complexes favours the square-planar configuration.
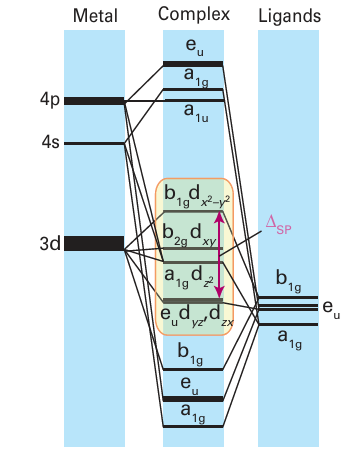
Figure 22.2 The energy levels of the molecular orbitals of a square-planar complex with strong-field ligands. The eight lowest MOs correspond to bonding interactions, with the higher MOs corresponding to antibonding interactions; the MOs are labelled with the d orbitals from which they are derived.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















