

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تركيب جزىء البنزين
المؤلف:
د. محمد بن إبراهيم الحسن – د. حسن بن محمد الحازمي
المصدر:
أسس الكيمياء العضوية
الجزء والصفحة:
ص122-119
2025-01-08
1638
اقتراح ككيولي : لقد اقترح العالم ككيولي (1865م) أن البنزين عبارة عن حلقة سداسية الأضلاع تتكون من ست ذرات كربون وست ذرات هيدروجين كل واحدة من ذرات الهيدروجين متصلة بذرة كربون، واقترح كذلك أن البنزين يحتوى على ثلاث روابط مضاعفة لكي تنطبق القاعدة التي تنص أن الكربون رباعي التكافؤ ، وأن تلك الروابط المضاعفة تتحرك إلى الأمام وإلى الخلف بشكل سريع كي تكون الأشكال الآتية التي لا يمكن فصلها
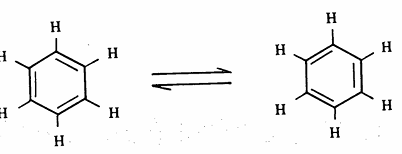
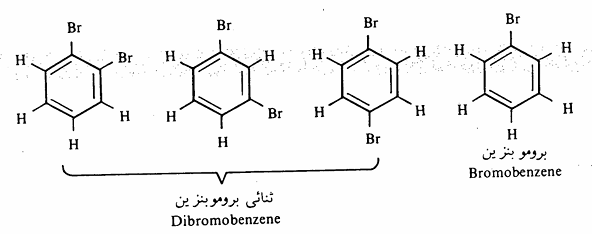
هذا الاقتراح يفسر الحقيقة التي تنص على وجود مركب واحد فقط لبرومو بنزين أي أنه لا يوجد متشابهات أخرى كما أنه يوجد ثلاثة متشابهات فقط لثنائي برومو بنزين وهذا دليل على أن جميع ذرات
الهيدروجين الستة متكافئة.
بالرغم من أن اقتراح ككيولي منسجم مع كثير من نتائج التجارب الخاصة بالبنزين إلا أنه لم يحل المشكلة بشكل نهائي فيما يتعلق بالثبات الكيميائي غير العادي للبنزين مقارنة بالأوليفينات. فإذا كان البنزين يحتوي على ثلاث روابط مضاعفة، كما اقترح ككيولي، فإنه يجب أن يتفاعل مع البروم (Br2) كما لو كان أوليفين ولكن في الواقع نجد أن البنزين إلى حد ما خامل تجاه البروم. لذلك فإن البنزين لا يمكن أن يكون لديه ثلاث روابط مضاعفة كما هو مقترح.
- التأرجح (الطنين) في حلقة البنزين تنص نظرية التأرجح على أنه) كلما أمكن تمثيل مادة بشكلين (أو اكثر) متكافئين أو قريبين للتكافؤ في التركيب ومختلفين فقط في موقع الكترونات التكافؤ دون المساس بهيكل المجموعة، فإن الجزىء الأصلي لا يمثل أياً منهما، ولكن عبارة عن هجين تأرجحي لجميع التأرجحية».
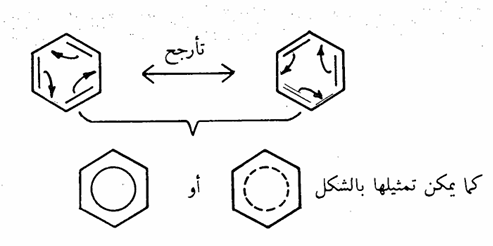
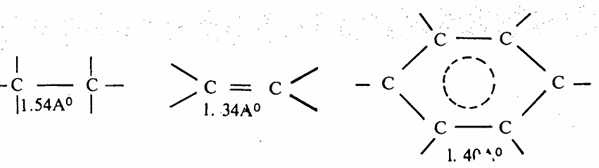
وبالرجوع إلى جزىء البنزين فإن الشكلين السابقين لجزىء البنزين لا يمثلان الجزىء ولكن الشكل الحقيقي لجزىء البنزين عبارة عن هجين تأرجحي من هذين الشكلين وبناء على أنه هجين فإن الروابط في كلا الشكلين تكون متساوية. ولقد ثبت من القياسات الفيزيائية أن طول كل رابطة هو 1.40 أنجستروم وهذه قيمة عددية متوسطة بين القيمة العددية التي تخص الرابطة الأحادية (1.54 أنجستروم) وبين القيمة التي تخص الرابطة الثنائية (1,34 أنجستروم).
نجد أن الشكل التأرجحي السابق أكثر استقراراً من ككيولي السابقة، بمعنى آخر أن الثبات الناشيء من التأرجح كبير لدرجة أن روابط الباي π- bonds الروابط الثنائية للجزيء تقاوم الكسر على عکس ما هو موجود في الأوليفينات , يجب أن لا يفوتنا أن شرط حدوث التأرجح في أي جزىء هو وجود روابط مضاعفة (ثنائية) في حالة متناوبة، بمعنى آخر وجود رابطة يليها رابطة أحادية ورابطة ثنائية وهكذا كما هو الحال في ثنائية جزىء البنزين.
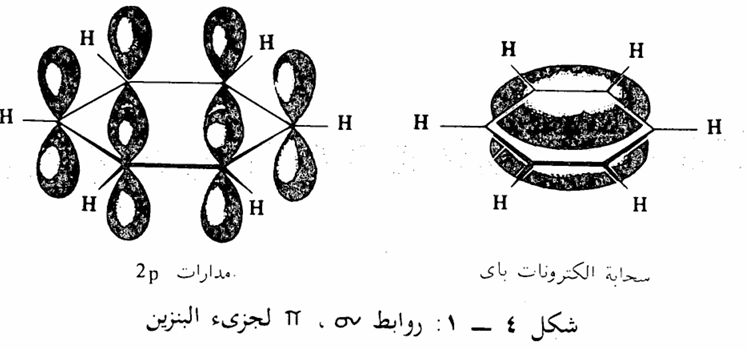
المدارات الجزيئية: المدارات الجزئية لجزىء البنزين تعطي صورة أوضح للرابطة المضاعفة في جزىء البنزين. نجد أن ذرات حلقة البنزين تقع في مستوى واحد وأنها مرتبطة مع بعضها على هيئة مسدس متساوي الأضلاع (زوايا 120) بها كل الروابط الست بين ذرات الكربون بنفس الطول (1,40 أنجستروم) وكل ذرة كربون مرتبطة بذرة هيدروجين، ولمثل هذا النوع من الروابط كل ذرة كربون يكون لديها مدارات من نوع sp2 ذرات الكربون الست مرتبطة مع بعضها البعض بشكل سداسي بروابط أحادية تتكون بتداخل مدارات من نوع 2sp وكل ذرة كربون مرتبطة بذرة هيدروجين برابطة سيجما Sigma bond ناتجة من التداخل بين مدارات 1s و sp2 بالإضافة إلى ذلك كل ذرة كربون تحتوي على مدار 2p يحتوي على الكترون واحد التداخل بين مدارات 2p السته يكون ثلاث روابط بای وبسبب تماثل الجزىء، فإن كلا من مدارات 2p يمكن أن يكون رابطة مع أى مدارات p2 في ذرتي الكربون المتجاورتين، أي أن مدارات باى تكون لا موضعية وبالتالي فإن كثافة الكترونات بای π -electrons تكون تماماً متماثلة حول حلقة البنزين مكونة سحابة الكترونية تمتد فوق وأسفل الحلقة وتؤدي إلى ثبات الجزىء واستقرار الحلقة، وبناء على ذلك. فإن الروابط بين ذرات الكربون لا تأخذ أبعاد أطوال الرابطة الأحادية أو الثنائية وإنما تكون أبعاد أطوال وسطية بين القيمة التي تخص الرابطة الأحادية والثنائية كما سبق وأن أوردنا والشكل 4 - 1 يوضح مدارات 2p وسحابة الكترونات باي الحلقة البنزين
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















