
ميكانيكية الانفجار
 المؤلف:
د. عبد الرحمن بن محمد الضباح - سلطان بن سعيد ال جابر
المؤلف:
د. عبد الرحمن بن محمد الضباح - سلطان بن سعيد ال جابر
 المصدر:
الكيمياء الجنائية
المصدر:
الكيمياء الجنائية
 الجزء والصفحة:
ص 68-72
الجزء والصفحة:
ص 68-72
 2023-12-09
2023-12-09
 2005
2005
تحدث الانفجارات عندما تكون سرعة الاحتراق للمواد المتفجرة أسرع من سرعة الصوت لذا فإن عملية الانفجار هي عملية احتراق ولكن بسرعة أعلى من سرعة الصوت تتكون المتفجرات -في الغالب - من الكربون C والأكسجين O2 والهيدروجين H2 والنتروجين N2 ونواتج هذه العملية في الغالب - هي ثاني أكسيد الكربون CO2 والماء H2O مع بعض المواد المتطايرة الاخرى مثل غاز النيتروجينN2 .
ومع أن التركيب النموذجي للوقود هو الكربون والهيدروجين فإن وقود المتفجرات يتميز باحتوائه على الأكسجين وتختلف وفرة الاكسجين من متفجر لآخر فمثلا يحتوي متفجر NG على نسبة كافية من الاكسجين بينما يحتوي متفجر TNT على الاكسجين لكن بنسبة منخفضة .
من جانب آخر فإن بعض المركبات قد لا تحتوي على أكسجين ومع ذلك تكون قوتها التفجيرية عالية مثل أزيد الرصاص المصنف كمتفجر أولي ولتعويض نقص الأكسجين في بعض المتفجرات يستعان بمصادر مؤكسدة خارجية تخلط مع المتفجر مثل الكلورات ClO3 و البيركلورات ClO4 وذلك لتعمل على زيادة القوة المتفجرة لها وجدير بالذكر إن سرعة التفجير تتراوح في المدى بين 1500-9000متر /ثانية مع العلم أن هذه السرعة تعتمد على الضغط ودرجة الحرارة حيث تؤثر درجة الحرارة في كثافة المتفجر وسرعة انفجاره حسب العلاقة التالية :
V=(331.4+0.6T) ms-1
حيث إن :
V: هي سرعة الصوت
T: درجة الحرارة بالمئوي م °
وعند 25م ° فإن سرعة الصوت هي 347م /ث ونتيجة لذلك فإنه أثناء عملية التفجير تتكاثر الموجة الانفجارية بسبب خليط التفاعل بحيث تصبح كثافة مواد الموجة الانفجارية أكثر من كثافة الهواء أي إنه كلما زادت كثافة الموجة الناتجة فإن سرعة الانفجار ستزداد وبالتالي ستزداد قوة انتشار الموجات الانفجارية ويجب ملاحظة أن السرعة الانفجارية لا تعتمد على نسبة الاكسجين الموجود في المتفجر فقط - مع أن هذا العامل له دور مهم في ذلك – فيعض المتفجرات تكون غنية بالاكسجين ومع ذلك بطيئة في الانفجار .
بينما متفجرات أخرى تتصف بأنها فقيرة بالاكسجين مثل مركبات النيترو العطرية (TNT RDX ) ومع ذلك فإنها تتميز بسرعات عالية في الانفجار أي إن السرعة الانفجارية للمتفجرات تعتمد على كل من : التركيب الكيمائي للمتفجر وعلى وضع الاكسجين في المركب من جانب آخر توجد أنواع من المتفجرات لا تحتوي على الاكسجين مثل الازيدات (N=N-) ومع ذلك تتميز بالقوة والسرعة العالية بسبب تفاعلات الاكسدة والاختزال بين الذرات الموجودة في المركب -أي ذرات تتأكسد وتفقد إلكترونات وذرات أخرى تختزل وتكتسب هذه الالكترونات وينتج عن هذه العملية تفاعلات كيميائية طاردة للحرارة ذات سرعة انفجار عالية .
من المفاهيم الهامة في علم المتفجرات مفهوم ميزان الاكسجين balance oxygen حيث يستفاد من هذا الميزان في معرفة ما إذا كان المتفجر يحتاج الى إضافة أكسجين أم أنه مكتف بذاته كذلك معرفة فيما إذا كان مصدر الاكسجين كيميائي أم لا ومن الامثلة على ذلك متفجري TNT و NG :

أولاً) النيتروجلسرين NG وصيغته الجزيئية هي C3H5N3O9 نجد أن :

في المثال نجد أن ميزان الأكسجين حيث تبقى أكسجين حر من ضمن النواتج وذلك لأن استهلاكه في التفاعل أقل مما تم البدء به حيث تم بدء التفاعل بتسع ذرات من الاكسجين كما هو واضح في المعادلة الكيميائية السابقة وبعد حدوث التفاعلي تبقى من ضمن النواتج أكسجين حر لم يستهلك
ثانيا) ثلاثي نترات التولوين TNT وصيغته الجزيئية هي C7H5N3O6 نجد أن
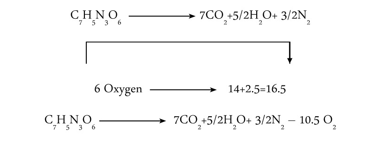
يلاحظ هنا أن ميزان الاكسجين سلبي حيث لم يتبق أكسجين حر من ضمن النواتج وذلك لأن كمية الاكسجين التي بدأ بها التفاعل قليلة ويحتاج التفاعل الى كمية إضافية من الاكسجين لإتمام التفاعل.
في المثالين السابقين وجد أن ميزان الاكسجين في NG يعطي قيمة إيجابية وهذا يعني إنه عند انفجار المادة وتحولها الى نواتج غازية فإن جزء من المتفجر يقوم بتوفير كمية من الاكسجين من المتفجر نفسه وهذا بدوره يساعد على زيادة الانفجار واستمرار الحريق أما في حاله TNT فوجد أن ميزان الاكسجين لديه سلبي وهذا يعني إنه يحتاج أكسجين من الهواء الجوي أو مصدر كيميائي للاوكسجين للقيام بعملية الانفجار ويمكن حساب النسبة المئوية لموازنة الاكسجين من العلاقة التالية :

ومثال على ذلك نحسب ميزان الاكسجين لل TNT

كما يلاحظ فإن ميزان الاكسجين سلبي، وهذا يجعل النظام ضعيفاً، وبالتالي يحتاج لمقدار إضافي من الأكسجين من مصدر خارجي، ويوضح الجدول (3-3) مجموعة لأهم المتفجرات وميزان الأكسجين لها) 1 (.

____________________
(1 )Bell, Suzanne « Forensic Chemistry», Pearson Prentice Hall, UK,(2006)
 الاكثر قراءة في الكيمياء الجنائية
الاكثر قراءة في الكيمياء الجنائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


