

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
بنية الايتيلين . الرابطة المزدوجة كربون – كربون
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
2th ed p 295
6-3-2017
5020
بنية الايتيلين . الرابطة المزدوجة كربون – كربون
Structure of ethylene. The carbon – carbon double bond
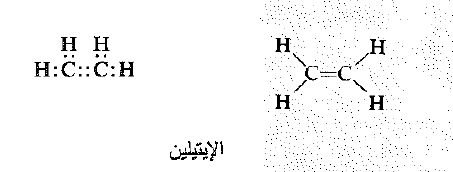
يعد الايثلين C2H4 أسط عضو في طائفة الالكانات ونظراً لإمكانية تحويل الايتلين إلى الاياتن يمكننا ان نتوقع وبشكل معقول بعض التشابه في البنية بين هذين المركبين.
بداية تربط ذرات الكربون برابطة تشاركية ثم بعد ذلك نربط ذرتين من الهيدروجين لكل ذرة كربون. نجد في هذه المرحلة ان كل ذرة كربون تمتلك ستة الكترونات في طبقتها التكافؤية عوضاً عن ثمانية، ولذلك يحتاج الجزيء الكلي إلى شفع من الالكترونات حتى يصبح معتدلاً.
يمكننا حل كلا المسألتين بفرض أن ذرات الكربون يمكنها المشاركة بشفعين من الالكترونات بشفعين من الالكترونات وللدلالة على هذه المشاركة بشفعين من الالكترونات نقول بأن ذرات الكربون ترتبط برابطة مزدوجة. تعد الرابطة المزدوجة كربون – كربون هي الصفة التي تتميز بها بنية الالكنات.
يعطي ميكانيك الكم معلومات اكثر تفصيلاً عن بنية الايتيلين وعن الرابطة المزدوجة كربون – كربون. ويستعمل الكربون لتشكيل روابط مع ثلاث ذرات كربون ثلاثة مدارات هجينة متكافئة. تشكل المدارات Sp2 من مزج مدار واحد من نوع s ومدارين من نوع p، تتوضع المدارات Sp2 في مستو واحد هو مستوي نواة هذا الترتيب المثلثي (الشكل 1.1) للمدارات الهجينة ان تبتعد عن بعضها إلى أقصى حد ممكن بنفس الطريقة التي تؤدي فيها التدافع بين المدارات الى تشكيل روابط رباعية الوجوه.

الشكل (1.1) : المدارات الذرية: المدارات Sp2 الهجينة. وجهت المحاور باتجاه رؤوس مثلث متساوي الاضلاع.
إذا رتبنا ذرتي الكربون مع ذرات الهيدروجين الأربع في جزيء الايتلين بحيث نسح بالتراكب الاعظمي بين المدارات فإننا نحصل على البنية التي في الشكل 1.2 تقع كل ذرة كربون في مركز مثلث تتمركز عند زواياه ذرتي هيدروجين وذرة الكربون الاخرى. وتكون زاوية كل رابطة مساوية 120 ْ. على الرغم من ان هذه الروابط تتوزع بشكل مختلف حول نوى الكربون فإن كلاً منها بمفردها تشبه الروابط الموجودة في جزيء الايتان وهي متناظرة اسطوانياً حول الخط الواصل بين الذرتين وتعطى جميعها نفس التسمية الرابطة σ (رابط سيغما).

الشكل 1.2 : جزيء الايتيلين: تظهر الروابط σ فقط.
لم تكتمل بنية الجزيء بعد، على كل حال. عند تشكيل المدارات Sp2 تستعمل كل ذرة كربون مدارين فقط من مداراتها الثلاثة من نوع p. يتألف المدار P الباقي من فصين متشابهين يوجد احدهما فوق المستوى الذي يحوي المدارات Sp2 الثلاثة اما الآخر فيوجد تحت ذلك المستوى (الشكل 1.3) ويحتل كل مدار الكترون وحيد.
إذا تراكب المدار P من ذرة الكربون الاولى مع المدار P لذرة الكربون الثانية تتزاوج الالكترونات معاً وتتشكل رابطة إضافية.
ولتمييز هذه الرابطة عن الروابط a المتشكلة بصورة مختلفة ولأنها تشكلت بسب التراكب بين المدارات p فإنها تدعى بالرابطة π (الرابطة بي) وتتألف من جزأين، سحابة الكترونية أولى تمتد فوق المستوى الذي يحوي ذرات الكربون بينما تمتد السحابة الأخرى تحت ذلك المستوى.

الشكل 1.3 : جزء الايتيلين : الرابطة المزدوجة كربون – كربون يعطي تراكب المدارات p الرابطة π ، توجد السحابة π
وبسبب التراكب الأقل تكون الرابطة π أضعف من الرابطة كربون – كربون من نوع a وكما يظهر لنا من الشكل 1.3 هذا التراكب لا يحصل إلا عندما تقع الذرات الست في مستو واحد . وبذلك تكون بنية جزيء الايتلين مستوية.
تتألف الرابطة المزدوجه كربون – كربون من رابطة قوية من نوع σ ورابطة ضعيفة من نوع … وتكون طاقة الرابطة الكلية مساوية 146 كيلو حريرة وهي اكبر من طاقة الرابطة – كربون الاحادية في الايتان (88 كيلو حريرة).
فنظر لارتباط ذرات الكربون بشكل اقوى، يكون طول الرابطة C – C في الايتيلين اقل من طول الرابطة C – C في الايثان.
وبذلك يمكننا القول ان الرابطة المزدوجه كربون – كربون اقصر من الرابطة الاحادية كربون – كربون .
تقدير طاقة الرابطة σ في الايتيلين بنحو 95 كيلو حريرة وهي اقوى من طاقة الرابطة σ في الاتيان لأنها تشكلت من تراكب المدارات SP2 وعلى هذا الأساس، فإننا نتوقع ان تكون طاقة الرابطة … في الايتيلين نحو 51 كيلو حريرة.

الشكل 1.4: جزيء الايتيلين الهيئة والمقاس
أثبتت بالدليل المباشر بنية الإيتيلين وفق ميكانيك الكم. حيث تظهر دراسات انعراج الالكترونات والدراسات الطيفية أن الإيتيلين (الشكل 1.4) جزيء مستو وبزوايا روابط قريبة جداً من الــ 120 ْ وطول رابطة C – C فيه تساوي 1.34 A مقارنة مع 1.53 A طول الرابطة C – C في الإيتان (انظر الشكل 1.5).
تلك بالإضافة إلى القياسات المباشرة فإننا سرعان ما سنرى ان هناك مفهومين لكيمياء الالكنات يتوافقان مع الصورة الميكانيكية الكمية للرابطة المزدوجة ويمكن فهمهما بسهولة بدلالة هذه الصورة وهما (أ) مفهوم التدوير المعاق المرافق لظاهرة التماكب الهندسي و (ب) نوع التفاعلية المميزة للرابطة المزدوجة كربون – كربون .

الشكل 1.5 : التشكيل الالكتروني والشكل الجزيئي نموذج جزيء الايتيلين : منظران
 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















