
الذوبانية : المواد المذابة الايونية. المذيبات البروتونية واللابروتونية. الازواج الايونية
 المؤلف:
Robert T. Morrison & Robert. N Boy
المؤلف:
Robert T. Morrison & Robert. N Boy
 المصدر:
الكيمياء العضوية Organic chemistry
المصدر:
الكيمياء العضوية Organic chemistry
 الجزء والصفحة:
p 274 - 6th ed
الجزء والصفحة:
p 274 - 6th ed
 21-2-2017
21-2-2017
 8801
8801
الذوبانية : المواد المذابة الايونية . المذيبات البروتونية واللابروتونية. الازواج الايونية
Solubility : ionic solutes . protic and aprotic solvents. Ion pairs
لنعد الآن إلى انحلال المركبات الايونية.
ان القوي التي تمسك الشبكة الايونية ببعضها قوية. ويتطلب التغلب عليها طاقة كبيرة. تتوافر هذه الطاقة من تشكل العديد من الروابط الايونية – ثنائية القطب بين الايونات والمذيب. يتجمع حو كل ايون نقود من جزيئات المذيب حيث تتجه نهاياتها الموجبة نحو الايون السالب، وتتجه نهاياتها السالبة نحو الايون الموجب .
لحل المركبات الايونية يجب ان يكون المذيب عالي القطبي. إضافة إلى ذلك رأينا انه يجب ان يملك ثابت عزل كهربائي مرتقع، وهذا يعني انه يجب ان يكون عازلاً جيداً ليخفض التجاذب بين الايونات المتعاكسة الشحنة عندما تذوب.
يعود السبب في تفوق الماء بوصفه مذيباً للمواد الايونية جزئياً إلى قطبيته وثابت العزل الكهربائي له. توجد سوائل أخرى تملك عزوم ثنائي قطب كبيرة وثوابت عزل كهربائي مرتفع ، ومع ذلك فهي مذيبات رديئة جداً للمركبات الايونية. والمطلوب هو قوة لتذوب، اي القدرة على تشكيل روابط قوية لحل الايونات. ليست قوة التذوب ببساطة عبارة عن عزم ثنائي قطب مرتفع، ولكنها تتعلق بطبيعة الروابط (ايون – ثنائي قطب) المتشكلة. ولمعرفة ما يعني ذلك يجب ان ننظر بعمق اكثر في بنية المذيب. لنبدأ بدراسة الماء.
قلنا إن الكاتيونات تنجذب إلى القطب السالب المذيب القطبي. من الواضح ان القطب السالب في الماء هو الاكسجين . يتميز الاكسجين بكهرسلبية عالية، والأهم من ذلك انه يملك اشعاع الكترونية غير المشترك بها.
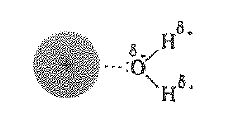
فضلاً عن ذلك يكون الاكسجين مكشوفاً جيداً لأنه مرتبط بذرتي هيدروجين ضئيلتين . يستطيع عدد من ذرات الاكسجين في عدد من جزيئات الماء ان يتجمع حول الكاتيون دون تزاحم.
قلنا ان الانبوتان تنجذب إلى القطب الموجب للجزيء القطبي. من الواضح ان الاقطاب الموجبة في الماء تكون عند ذرات الهيدروجين. ان الروابط (ايون – ثنائي قطب) التي تمسك الانيونات إلى الماء ما هي إلا روابط هيدروجينية.
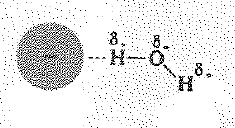
يسمح الربط الهيدروجيني بتذوب خاص وقوي للأنبوبات. لا يكاد ذلك فقط بسبب وجود شحنة موجبة قوية متمركزة على ذرة صغيرة جداً وهي ذرة الهيدروجين، بل لأن الهيدروجين يبرز من الجزيء ويكون مكشوفاً تماماً. يمكن للأنيون ان يمسك بعدد من الروابط الهيدروجينية الموجودة على عدد من جزيئات الماء دون تزاحم.
وهكذا يعزى الجزء الأكبر من قوة التذوب المميزة الماء إلى زمرة –OH فهي تذوب الكاتيونات بقوة عبر اشفاع الالكترونات غير المشترك بها للأكسجين. وهي تذوب الانبونات بقوة عبر الارتباط الهيدروجيني.
يشبه الميتانول الماء في امتلاكه الزمرة –OH وليس مستغرباً ان يذوب الميتانول المركبات الايونية (غير انه ادنى في فعله هذا من الماء، فهو اقل قطبية، وان الزمرة –CH3 أكبر وتسبب تزاحماً من التزاحم الذي تحدثه ذرة الهيدروجيني الثانية للماء.
تدعي المذيبات المشابهة للماء والميتانول بالمذيبات البروتونية ، وهي مذيبات تحتوي على هيدروجين يرتبط إلى الاكسجين أو النتروجين، ولذلك فهو حمضي بصورة تكفي لتشكيل روابط هيدروجينية. المذيبات البروتونية الاخرى تذوب الايونات بالطريقة نفسها التي يقوم بها الماء، اي انها تذوب الكاتيونات عبر الاشفاع الالكترونية غير المشترك بها، وتذوب الانيونات عبر الربط الهيدروجيني. شهدت السنوات الاخيرة تطوراً وانتشاراً واسعاً في استخدام المذيبات اللابروتونية، هي مذيبات ذات ثوابت عزل كهربائي متوسطة الارتفاع، ولا تحتوي على هيدروجينات حمضية. نذكر منها على سبيل المثال:
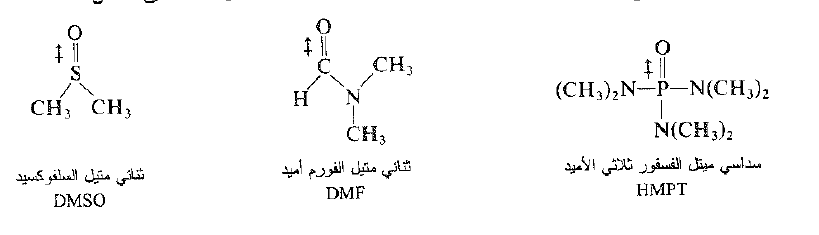
تذوب هذه المذيبات المركبات الايونية، ولكنها تختلف في طريقة عملها هذا عن المذيبات البروتونية اختلافاً جذرياً، فهي لا تستطيع تشكل روابط هيدروجينية مع الأنيونات.
هذه المذيبات اللابروتونية عالية القطبية، ولها عزوم ثنائيات اقطاب اكبر عدة مرات من عزم ثنائي قطب الماء. وكما تشير اصيغ فإن القطب السالب في كل من امثلتنا يقع عند ذرة الاكسجين التي تبرز إلى خارج الجزيء (انظر الشكل 1.1). تذوب الكاتيونات بقوة وذلك عبر الاشفاع الالكترونية غير المشترك بها والموجودة عند ذرات المشحونة سلباً والمكشوفة تماماً.
يكون القطب الموجب من ناحية اخرى مدفوعاً داخل الجزيء، وعبر هذه الشحنة المنتشرة والمحجوبة يمكن للجزيء ان يذوب الانيونات بشكل ضعيف جداً. بشكل ضعيف جداً. وهكذا نستطيع المذيبات اللايروتونية ان تذوب المركبات الايونية ، بشكل رئيس، عبر تذوبيها الكاتيونات.

الشكل 1.1 : مذيب لابروتوني قطبي: وسداسي متيل فسفورو ثلثي الاميد (HMPT). يظهر الجزيء بقطبه السالب على ذرة الاكسجين (في قمة الشكل) المتجه إلى الاعلى، بينما يكون القطب الموجب عند ذرة الفسفور (التي تحتها مباشرة) المتجه إلى الاسفل. وكما نرى فإن الاكسجين يبرز خارج الجزيء ويكون مكشوفاً وسهل المنال، وهو يستطيع عبر شحنته الموجبة محجوبة عن الخارج بزمر كبيرة الحجم، وهو ينجذب انجذاباً ضعيفاً نحو الانيونات.
الآن ، وكما رأينا سابقاً في حالة الاستبدال النوكليوفيلي تكون غالبية المركبات العضوية مهتمة بتفاعلات بين المركبات اللاأيونية (عموماً عضوية) وبين مركبات أيونية (لا عضوية وعضوية)، ومن الضروري اختيار المذيب الذي تذوب فيه الكواشف من النوعين كليهما. يذوب الماء المركبات الايونية جيداً، ولكنه مذيب رديء لمعظم المركبات العضوية. تعد المذيبات اللاقطبية مثل الإيتر والكلوروفورم والبنزين مذيبات جيدة للمركبات العضوية، ولكنها مذيبات رديئة جداً للأملاح اللاعضوية . تقدم الكحولات وبخاصة الدنيا منها الميتانول والايتانول طريقة وحيدة وهي الطريقة التقليدية للخروج من هذه المشكلة تساعد الزمر الالكيلية المحبة للشحوم هذين الكحولين في إذابة الكواشف العضوية للأأونية، بينما تسمح الزمر الهيدروكسيلية فيهما بتذوب الكواشف الايونية. وهكذا فإن الميتانول والايتانول، بوفران كل على حدة او عندما يكون ممزوجاً بالماء، وسطاً يساعد ، على سبيل المثال، على حدوث الاستبدال النوكليوفيلي الاليفاتي عموماً.
غير ان الماء والكحولات مذيبات بروتونية. وقد رأينا ان هذه المذيبات تستطيع ان تذوب الانيونات بقوة عبر الربط الهيدروجيني ، وهذه الانيونات تشكل عادة النصف المهم من الكاشف الايوني وهكذا، وعلى الرغم من انا لمذيبات البروتونية تذوب الكاشف وتجعلها في تلامس مع الجزيء العضوي، فإنها تثبت في الوقت نفسه الانيونات وتخفض من تفاعليتها بشكل كبير، وهي تضعف أساسيتها وتضعف معها قوتها النوكليوفيلية (الفقرة 8.5).
هنا يأتي دور المذيبات اللابروتونية . فهي تذوب المركبات العضوية عبر اجزائها المحبة للشحوم. وهي تذوب ايضاً المركبات اللاعضوية، ولكنها نفعل ذلك، كما رأينا منذ قليل، عبر تذويبها الكاتيونات. وتترك الانيونات غير معاقة نسبياً وعلى درجة عالية من التفاعلية، وهي اكثر اساسية واكثر نوكليوفيلية.
وقد امكن الحصول باستخدام هذه المذيبات اللابروتونية على تأثيرات مثيرة في تشكيلة واسعة من التفاعلات. التفاعلات التي تجري في مذيبات بروتونية ببطء عند درجات عالية من الحرارة معطية مراديد منخفضة ، وجد انها تجري في مذيبات لا بروتونية بسرعة عند درجة حرارة الغرفة معطية مراديد عالية. عند تغيير المذيب إلى المذيب لا بروتوني يمكن ان تزداد سرعة التفاعل بمليون مرة تقريباً.
ومثلما تختلف المذيبات في قدرتها على تذويب الايونات ، فإن الايونات تختلف في ميلها إلى التذوب. الشحنة المركزة على أيون صغيرة "قاس" يؤدي إلى ربط (أيون – ثنائي قطب) أقوى من الشحنة الموزعة على ايون اكبر "لين" وهكذا فإنه في مذيب معين يتذوب F- بقوة أكبر من تذوب Cl- و Li+ يتذوب بقوة اكبر من تذوب Na+.
توجد طريقة بديلة لدراسة استقرار ايون ما بالمذيب. وطبقاً لقوانين الكهرباء الساكنة رأينا ان استقرار المنظومة المشحونة يزداد عند تشتت الشحنة . لندرس مثلاً حالة ايون متذوب. تتجه النهايات الموجبة لجزيئات المذيب نح الانيون وتعدل جزئياً شحنته، واثناء عملها هذا فهي نفسها تنعدل جزئياً. ويترك هذا جزيئات المذيب مع شحنة سالبة صافية، وهذا يعني ان النهايات السالبة الخارجية لا تبقى متوازنة تماماً مع النهايات الموجبة الداخلية. تصبح الشحنة السالبة المتركزة اصلاً على الانيون الآن موزعة على مجمل السطح الخارجي الواسع جداً لجزيئات المذيب المتجمعة. ويؤدي هذا إلى تشتيت كبير جداً للشحنة، وبالتالي إلى استقرار هائل للأنيون . وتتثبت الكاتيونات بالطريقة نفسها، طبعاً، بتشتت الشحنة الموجبة على كامل جزيئات المذيب المتجمعة.
ومثل هذا التشتت اكثر اهمية في استقرار الايونات الصغيرة مثل F- و Li+ ، أكثر مما هو في جزيئات اكبر مثل I- أو Rb+ التي تكون الشحنة موزعة اصلاً على سطح واسع نسبياً.
يميل توزع الشحنة سواء عبر التذوب او داخل الايون نفسه إلى تثبيت الكاتيونات والانيونات العضوية مثلما يحدث بالنسبة للأيونات اللاعضوية. ويلعب هذا التصور دوراً رئيسياً في فهمنا للجزء الكبير من الكيمياء العضوية التي تتضمن مثل هذه الحقائق المتوسطة، وكنا قد بدأنا نتحقق سابقاً من ذلك عند دراستنا للكربوكاتيونات في الفصل الخامس.
وقد ناقشنا حتى الآن في هذه الفقرة تآثر الانيون مع المذيب. ولكن يوجد مكون آخر للمحلول يجب اخذه في حسباننا. فلكل ايون معاكس له ، وهذا يعني انه يجب ان يوجد بالضرورة ايون ذو شحنة معاكسة. يكون الايون اللاعضوي في المحاليل المائية الممددة متذوباً بقوة ومعزولاً بصورة جيدة عن شحنة ايونه المعاكس. أما في مذيب ذي قوة مذوبة اضعف أو ذي ثابت عزل كهربائي أخفض، كما في الميتانول مثلاً، أو في احد المذيبات اللابروتونية التي درسناها فإن الايون يشعر بهذه الشحنة وينجذب إليها. يوجد قياس للربط الايوني ، ويدعى شفع الايونات المختلفين في شحنتهما بالشفع الايوني.
تعتمد قوة الربط الايوني على طبيعة المذيب. يكون الربط الايوني في المذيبات التي تذوب بصورة ضعيفة قوياً، حيث لا توجد جزيئات للمذيب بين شفع الايونات، وهنا نقول ان الشفع الايوني متلازم بشدة. يكون الربط الايوني في المذيبات التي تذوب بقوة ضعيفاً، حيث يمكن لطبقة (أو طبقات) جزيئات المذيب ان تفصل شفع الايونات وهنا نقول ان الشفع الايوني غير متلازم بشدة.
تلعب الاشفاع الايونية العضوية منها واللاعضوية دوراً مهماً للغاية في الكيمياء العضوية. يخضع الايون في المحلول إلى قوى عديدة، ويكون التأثير المثبت للأيون المعاكس (تأثير المذيب مثلاً) هو التأثير الذي يجب اخذه في الحسبان دائماً.
*شفع = زوج
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


