
ميكانيكية بديلة للهلجنة An alternative mechanism for halogenation
 المؤلف:
Robert T. Morrison & Robert. N Boy
المؤلف:
Robert T. Morrison & Robert. N Boy
 المصدر:
الكيمياء العضوية Organic chemistry
المصدر:
الكيمياء العضوية Organic chemistry
 الجزء والصفحة:
p 64 - 6th ed
الجزء والصفحة:
p 64 - 6th ed
 8-11-2016
8-11-2016
 2934
2934
ميكانيكية بديلة للهلجنة An alternative mechanism for halogenation
لقد انصب اهتمامنا في الفقرة السابعة، على التفاعليات النسبية لمختلف الهالوجينات تجاه الميثان. وسوف تغير وجهة نظرناً، حيث نعني بالتفاعليات النسبية لمختلف الألكانات – أو مختلف المواقع في ألكان ما – تجاه هالوجين محدد. ستؤلف كل هذه المساعدات، جزءاً مهماً من دراستنا للكيمياء العضوية، وكيف سنقود الاختلاف في البنية الى اختلاف في التفاعلية. غير أن هنالك نقطة أكثر أساسية يجب الاهتمام بها هي:
كيف يمكن لنوع معين من البنية أن يؤدي الى نوع معين من التفاعلات، في المقام الأول؟ لماذا هذا الهالوجين بالذات أ, هذا الألكان بالذات يتفاعل أسرع أو أبطأ من الآخر، بل ولماذا أي هالوجين وأي ألكان يتفاعلان مع بعضهما، وفق الطريقة التي نشاهدها.
وللإجابة على هذا السؤال دعونا نأخذ مثالاً كلورة الميثان، ونتفحصها عن كثب. إن خطوتي سلسلة الانتشار في آليتنا هما (2 أ) و(3 أ).
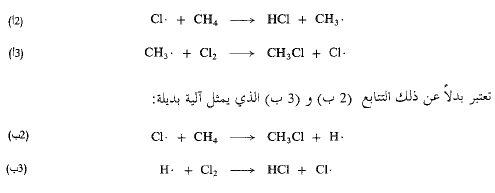
يبدو من النظرة الأولى الى هذه الميكانيكية أنها اختيار يستحق الاهتمام ولقد كانت، بالفعل، وحتى (1940) تعد متوافقة مع الحقائق التجريبية بمقدار توافق الميكانيكية المقبولة الآن.
ولكن هذه الميكانيكية البديلة ليست هي التي تحدث وفقها الكلورة.
يغدو سؤالنا، إذن، كما يلي: كيف تحدث الكلورة وفق (2 أ) و(3 أ) وليس وفق (2 ب) و(3 ب)؟ يقع لب الموضوع في الخطوة (2) حيث يفترق، هنا مسارا التفاعل؛ فما يحدث في (2) يحدد مجمل مسار التفاعل. وإذا كان على الخطوة (2 ب) أن تحدث فإن (3 ب) هو تفاعل معروف يحدث بسهولة في منظومة مختلفة. ولكن (2 ب) لا يمكن أن تحدث.
وهكذا، فقط ضيقنا مجال استعلامنا فنحن نسأل الآن: لماذا يحدث (2 أ) وليس (2 ب)؟
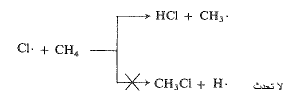
تهاجم ذرة كلور، في كلا التفاعلين، جزيء الميثان. فإما أن تربط نفسها الى هيدروجين وعندها تطلق جذر مثيل أو تربط نفسها الى كربون وعندها تطلق ذرة هيدروجين. وهكذا يوجد تنافس بين التفاعلين، والرابح هو التفاعل الأسرع. فإذا سيطر التفاعل (2 أ) يعني، ذلك أن (2 أ) يجري أسرع من (2 ب).
كيف يمكن أن نفسر ذلك؟ نرغب مثالياً في معرفة قيم (Eact) للتفاعلين المتنافسين. إلا أن (Eact) التفاعل (2 ب) لا يمكن قياسه طبعاً، لأن هذا التفاعل لا يحدث. وهكذا، كما فعلنا في الفقرة دعونا نرى ما يمكن فعله باستخدام قيم (AH)؛ التي يمكننا حسابها – من أجل تفاعلات حقيقية أو وهمية – من معطيات الذي يحوي طاقات التفارق المتجانس للروابط.
فمن أجل (2 أ) تكون (AH) مساوية +1 كيلو حريرة، ويمكن أن تكون (Eact) أقل من 1 كيلو حريرة، وكما رأينا فإنها في الواقع تساوي 4 كيلو حريرة.
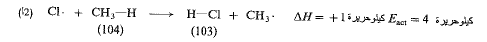
ومن أجل (2 ب) تكون (AH) مساوية + 20 كيلو حريرة ولذلك فإن (Eact) يجب أن تكون على الأقل 20 كيلو حريرة ويحتمل أن تكون أكبر بشكل ملموس.
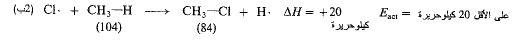
تكون نسبة التصادمات التي تولد 4 كيلو حريرة أو أكثر هي أكبر بشكل هائل من تلك التي تولد (20 كيلو حريرة): ففي الدرجة (275˚س)، على سبيل المثال، تكون أكبر بـ (2.5) مليون مرة! واعتماداً على هذا التقرير الأصغري للفرق في قيمة (Eact)، فإننا نرى أن على (2 أ) أن يحدث أسرع بكثير من (2 ب)، إن (2 أ)، في الحقيقة، هو التفاعل الذي يحدث، فقط.
والمسألة هي أن 20 كيلو حريرة هو بحد ذاته عال جداً يمنع حدوث التفاعل، وبعد كل هذا فان هجوم Br على الميثان يملك (Eact) من مرتبة 18 كيلو حريرة، ومع ذلك فهو يحدث. المسألة هنا هي أن تفاعلا ذا (Eact) من مرتبة 4 كيلو حريرة فقط.
عندما تصدم ذرة كلور جزيء الميثان، فإن التصادم يحتمل بشكل كبير أن يولد طاقة كافية لـ (2 أ) وليس لـ (2 ب). وهكذا فإن (2 أ) هو الذي يحدث.
وأخيراً، لنرى ما هي السمات البنيوية التي تجعل التفاعل (2 أ) أسهل من الآخر. تتضمن التفاعلات كسر رابطة كربون – هيدروجين، والاختلاف هو في الرابطة التي تتشكل، هيدروجين – كلور، أم كربون – كلور.
يتطلب كسر الرابطة كربون – هيدروجين 104 كيلو حريرة – كمية كبيرة من الطاقة. يوفر التصادم جزءاً صغيراً منها في حين يتوافر القسم الأعظم منها من تشكل الرابطة الأخرى الموافقة: هيدروجين – كلور في الحالة (2 أ)، أو كربون – كلور في الحالة (2 ب).
إن الرابطة هيدروجين – كلور هي الأقوى (103 كيلو حريرة) وإن تشكلها يقدم، تقريباً، كامل الطاقة اللازمة. أما الرابطة كربون – كلور، الأضعف (84 كيلو حريرة) أخرى زيادة على ذلك. إذن، يتعين، أخيراً، مسار هذا التفاعل بحقيقة أن الرابطة هيدروجين – كلور هي أقوى من الرابطة كربون – كلور.
يبين تفحص طاقات التفارق في الجدول (2.1) أن الذي وصفناه الآن هو جزء من نمط عام: يشكل أي هالوجين رابطة أقوى مع الهيدروجين من تلك التي يشكلها مع الكربون – ليس كربون الميثان فقط، بل كربون أي ألكان آخر. والنتيجة هي أنه، مهما يكن نوع الهالوجين ومهما يكن نوع الألكان، فإن عملية الهلجنة تتبع الميكانيكية الموافقة (2أ) و(3أ) وليس تلك الموافقة لـ (2 ب) و(3 ب).
ومن جديد، نواجه السرع النسبية لتفاعل ما، هذه المرة محددين المفهوم الأكثر جوهرية في السلوك الكيميائي: ما نوع التفاعل الذي يحدث. فكلما مزجت أنواع مختلفة من الجزيئات نجد من حيث المبدأ، أكثر من طريق يمكن أن تتفاعل وفقه. وسيحدث تنافس بين مختلف مسارات التفاعل وغالباً، كما سنجد، تنافس أقرب من ذلك الذي استخدمناه في مثالنا.
وأخيراً فإن ما تقوم به الجزيئات بالفعل هو الأمر الأسهل لها. وعندما تواجه مثل هذه الحالات من التنافس، يجب أن نحاول معرفة العوامل التي تفضل مساراً عن آخر؛ حتى أننا سنحاول، رؤية ما يمكننا فعله لجعل المسار الذي نرغبه هو الأكثر سهولة للتفاعل.
مسألة 3.2 احسب بشكل كمي لماذا تكون الخطوة الأولى في تفاعل كلورة الميثان حرارياً هي:
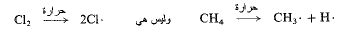
وما السمة البنيوية التي تحدد طبيعة خطوة المبادرة السلسلية.
مسألة : احسب بشكل كمي لماذا تتبع برومة الميثان الميكانيكية المماثلة لـ (2 أ) و(3 أ) وليس تلك المماثلة لـ (2 ب) و(3 ب).
 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


