
المعالجة الجديدة لذرة الهيدروجين أو نهاية ذرة بور
 المؤلف:
يوسف البناي
المؤلف:
يوسف البناي
 المصدر:
ميكانيكا الكم بين الفلسفة والعلم
المصدر:
ميكانيكا الكم بين الفلسفة والعلم
 الجزء والصفحة:
ص64–70
الجزء والصفحة:
ص64–70
 2023-10-16
2023-10-16
 2567
2567
لقد قمنا بمعالجة ذرة الهيدروجين وهي أبسط الذرات وأكثرها انتشارا في الطبيعة عن طريق نظرية الكم القديمة، وتحديدا من نموذج بور كان هذا النموذج الأخير يقتضي وجود نواة مكونة من بروتون واحد وإلكترون واحد يدوران حول بعضهما البعض، وبسبب ضخامة حجم النواة (البروتون في حالة ذرة الهيدروجين) بالنسبة للإلكترون، اعتبرنا أن النواة ساكنة والإلكترون يدور حولها.
لكن هذه الصورة البسيطة للذرة تخترق المبدأ الذي تكلمنا عنه منذ قليل، مبدأ عدم اليقين. إذ لو كان الإلكترون يدور بشكل دائري حول النواة لكان في مقدورنا أن نحدد كل من موقعه واندفاعه في وقت واحد، وهذا تعارض مباشر مع مبدأ عدم اليقين.
تم إعادة النظر في معالجة ذرة الهيدروجين، انطلاقا من نظرية الكم الحديثة (ميكانيكا الكم). تحديدا من معادلة شرودنغر، وتفسر بورن الاحتمالي، ومبدأ هايزنبيرغ الارتيابي. باستخدام هذه المفاهيم الجديدة نحصل على شكل جديد للذرة، يختلف تماما عن نموذج بور، ولكن يتفق بصورة جيدة مع التجارب. لكن نموذج بور لم يمت بالكامل، بل كل ما في الأمر انه يظهر كحالة من إحدى الحالات الكثيرة التي تظهر من نتائج نظرية ميكانيكا الكم، كما سنرى الآن 2.
سوف أقدم هنا النتائج النهاية لتصورات ميكانيكا الكم لذرة الهيدروجين، أن المعالجة الرياضية الكاملة لميكانيكا الكم ليست يسيرة وواضحة. لذا سوف أحاول هنا تقديم صورة رياضية بسيطة وموجزة للنظرية.
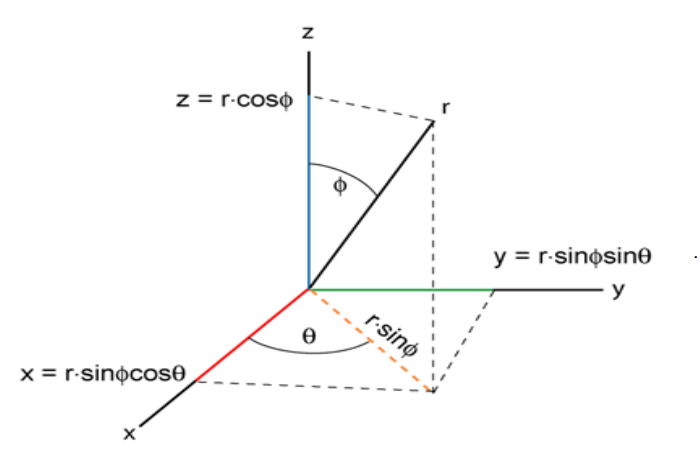
عند التعامل مع الإلكترون كشيء متحرك حول النواة فانه لا يتم استخدام الإحداثيات الكارتيزية، بل يتم استخدام الإحداثيات الكروية القطبية spherical polar coordinates.
يوضح الشكل (1–4) الإحداثيات الكروية وعلاقتها بالإحداثيات الكارتيزية.
أن معادلة شرودنغر هي معادلة تفاضلية من الدرجة الثانية، وتحل هذه المعادلة لتعطي في النهاية الدالة ψ. في حالة ذرة الهيدروجين سيكون الحل النهائي للدالة ψ مساويا لحاصل ضرب دالتين:
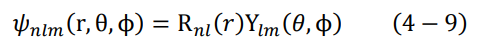
حيث n هو عدد الكم الرئيسي، وقد تكلمنا عنه في نموذج بور. l يسمى عدد الكم المداري orbital quantum number، و m يسمى عدد الكم المغناطيسي magnetic quantum number، وهما عددان جديدان ينتجان من حل معادلة شرودنغر. تسمى الدالة (r) Rnl بالدالة النصف قطرية radial function، وهي كما نلاحظ دالة في نصف القطر r (بعد النواة عن الالكترون). يعطى الناتج النهائي لهذه الدالة في حالة ذرة الهيدروجين كالتالي:
شكل (1–4)
العلاقة بين الإحداثيات الكروية والكارتيزية.

وهذا يفسر لنا الآن ما رأيناه في نموذج بور، من أن أقل مستوى طاقة للإلكترون هو 1 = n وليس 0 = n.
يتبقى لنا الآن الدالة (θ،Φ)im تسمى هذه الدالة بالدالة الكروية التوافقية spherical harmonic function، ويعطى الناتج النهائي لها كالتالي:
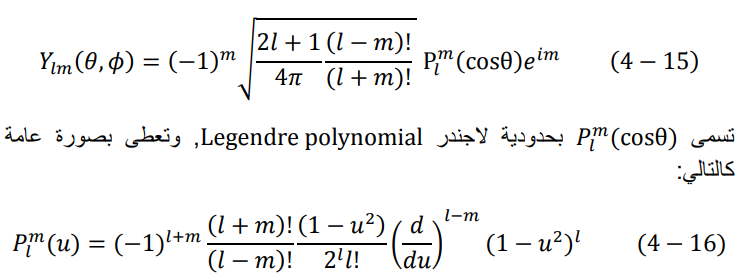
حيث u اي دالة عامة. في حالتنا هنا نجد θu = cos.
نلاحظ من الدالة (Rnl (r انها فقط تعتمد على عدد الكم الرئيسي n والمداري l، وهي دالة خاصة بالحركة النصف قطرية، أي تحدد كيفية تغير نصف القطر r حول النواة. اما الدالة (θ, Φ)Ylm فهي ترتبط بعدد الكم المداري l والمغناطيسي m، وهي دالة خاصة بالحركة الزاوية، أي تحدد كيفية تغير الزاوية θ فقط، لان الزاوية Φ تعتبر ثابته وسوف نبين ذلك عند دراسة كثافة الاحتمال.
للحصول على الشكل النهائي للدالة الموجية لذرة الهيدروجين، نقوم بتعويض العلاقتين (10–4) و(15–4) في (9–4):

لاحظ أن هذه الدالة الموجية التي تصف إلكترون حقيقي يدور حول النواة، تحتوي على العدد المركب 1–√ i = وهذه نقطة اثارت تساؤلات وحيرة حول كيفية وصف المعادلات الرياضية للأنظمة الفيزيائية، اذ كيف تصف دالة مركبة نظام فيزيائي حقيقي؟ ان الحل الوحيد لهذه المشكلة هو اقتراح ماكس بورن، فالدالة الناتجة من حل معادلة شرودنغر لا تحمل في حد ذاتها معنى فيزيائي محدد، ولكن مربع هذه الدالة يعطي معنى فيزيائي، وهو احتمال تواجد الإلكترون في مكان ما.
عند دراسة نظام معين في ميكانيكا الكم، تجرى جميع العمليات الرياضية لإيجاد شيئين مهمين، وهما الدالة المميزة eigen function والقيمة المميزة eigenvalue. في حالة ذرة الهيدروجين تكون الدالة المميزة هي الدالة الموجية المعطاة بالعلاقة (17-4)، أما القيمة المميزة فهي تعبر عن قيمة طاقة المدارات En. تعطى تلك القيمة المميزة بشكلها النهائي كالتالي:
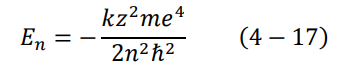
وليست هذه سوى معادلة صديقنا القديم بور، المعادلة (33-2). الآن، يتبين لنا سبب فشل نموذج بور على الحالات الأكثر تعقيدا من ذرة الهيدروجين، فلقد كان نموذج بور خليط ما بين الفيزياء الكلاسيكية والكمومية. أما الآن في ميكانيكا الكم، لم نستخدم أي شيء من الميكانيكا الكلاسيكية، وقد أتت نظرية بور كحالة خاصة لميكانيكا الكم.
بعد معرفة الدالة المميزة والقيمة المميزة، سنقوم بدراسة أبسط حالات الطاقة، وذلك عندما يكون الإلكترون في مستوى الطاقة الأول 1 = n. عندما تكون 1 = n، نجد من المعادلة (14-4) 0 = l، وفي هذه الحالة تكون ايضا 0 = m. بالتعويض عن قيمة 1 = n و0 = l في المعادلة (11-4) نجد أن 0 = kmax. نقوم الآن بالتعويض في المعادلة (13-4) مع استخدام k = 0، نجد أن 0 = a1، وهذا يعني من المعادلة (12-4) أن الحدودية (ρ)H لا تملك معامل واحد وهو aº. تصبح الدالة (Rnl (r في هذه الحالة كالتالي:

بعد معرفة شكل الدالتين النصف قطرية والكروية التوافقية، يصبح الشكل النهائي للدالة المميزة لذرة الهيدروجين في مستوى الطاقة الأول كالتالي:
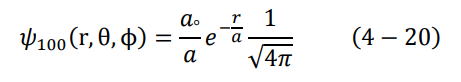
نستخدم الآن شرط المعايرة، المعادلة (7-4) لإيجاد الثابت aº:
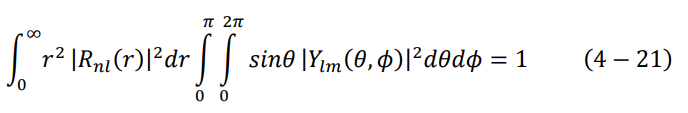
وطالما أن التكامل حول الدالة التوافقية الكروية يساوي واحد، تصبح المعادلة كالتالي:
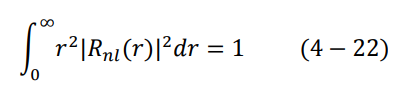
من هذه المعادلة نجد أن 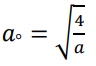 ، وبهذا يكون الشكل النهائي للدالة الموجية لإلكترون ذرة الهيدروجين في مستوى الطاقة الأول 1 = n كالتالي:
، وبهذا يكون الشكل النهائي للدالة الموجية لإلكترون ذرة الهيدروجين في مستوى الطاقة الأول 1 = n كالتالي:

وهي بالضبط نفس القيمة التي وجدناها في نموذج بور.
بينا فيما سبق أن نموذج بور ينتهك مبدأ عدم اليقين، وهو أحد الدعائم الرئيسية في نظرية ميكانيكا الكم. إذ لو كان الإلكترون يدور بشكل دائري أو بيضاوي لاستطعنا تحديد كل من موقعه وسرعته في آن واحد، ولكن هذا يخالف مبدأ عدم اليقين. كذلك يخالف نموذج بور التفسير الاحتمالي لميكانيكا الكم، لقد وجدنا أن مربع الدالة الموجية الآتية من حل معادلة شرودنغر يتناسب مع احتمال تواجد الإلكترون في أماكن معينة وليس في مكان محدد بالضبط. إذن في ذرة الهيدروجين قد يكون الإلكترون على بعد يساوي البعد الذي تنبأ به بور (نصف قطر بور)، لكن هذا لا يعني بأنه يوجد على هذا البعد دائما، فالتفسير الاحتمالي يعطي إمكانية للإلكترون بالتواجد على بعد أكبر أو أصغر من نصف قطر بور وباحتمالات متعددة. وهذا ما سنراه الآن.
لنأخذ أولا تربيع الدالة (r)Rnl ، وهذه تعطينا الاحتمالية النصف القطرية (بعد الإلكترون عن النواة r). اذا عرفنا r)dr)P على انها احتمالية تواجد الالكترون بين المسافة r وr + dr عن النواة، فانه بحسب التفسير الاحتمالي يكون لدينا:

وتعطي هذه المعادلة كثافة الاحتمال الطولية أو النصف قطرية. طالما أن 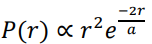 ، يكون أكبر احتمال لتواجد الالكترون في الحالة الارضية 1 = n، هو:
، يكون أكبر احتمال لتواجد الالكترون في الحالة الارضية 1 = n، هو:
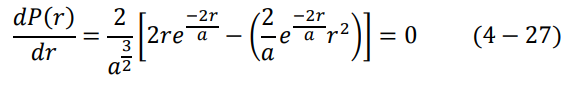
ولا تتحقق هذه المعادلة إلا عندما r = a، أي أن أكبر احتمال لتواجد الكترون ذرة الهيدروجين في المستوى الأرضي 1 = n هو نصف قطر بور، مما يبين لماذا كان نموذج بور ناجح في حالات الذرة وحيدة الالكترون. يوضح الشكل (2–4) كثافة الاحتمال النصف قطرية (P(r للحالة الارضية وبعض حالات الاثارة كدالة في r/a.
لم تنته الأمور عند هذا الحد، فيجب النظر في كثافة الاحتمال الزاوية للدالة الكروية التوافقية (θ, Φ)Ylm. لحسن الحظ في هذه الحالة أي عندما تكون 0 = l و 0 = m، فإن كثافة الاحتمال لا تعتمد لا على الزوايا θ ولا على Φ، لذلك يكون مربع الدالة (θ, Φ)Ylm يساوي مقدار ثابت:
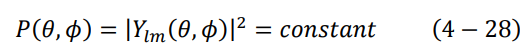
وبالتالي يصبح شكل دالة كثافة الاحتمال متناظر كرويا ولا يعتمد على θ أو Φ، كما هو موضح بالشكل (3–4).
الآن وللحصول على الشكل النهائي لكثافة الاحتمال، نقوم بضرب المعادلتين (26–4) و(28-4)
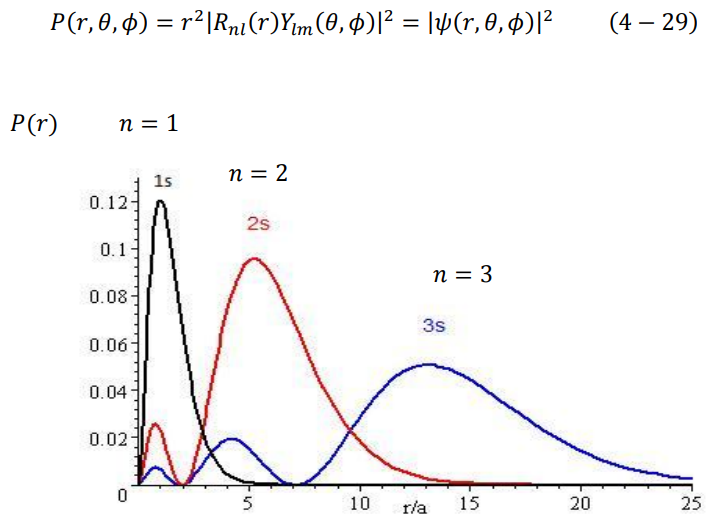
شكل (2–4)
توزيع دالة كثافة الاحتمال (P(r للحالة الأرضية، وبعض حالات الاثارة كدالة في r/a .
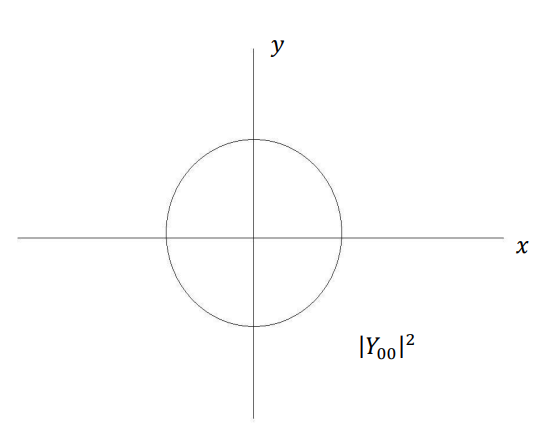
شكل (3–4)
التماثل الكروي لمربع دالة الاحتمال 2|Y00|. حيث لا تعتمد كثافة الاحتمال على الزاويتان θ وΦ.
يوضح الشكل (4–4) توزيع كثافة الاحتمال النهائية، حيث شكل التوزيع كروي متناظر في ثلاث أبعاد والشكل (5–4) يوضح توزيع دالة كثافة الاحتمال لمجموعة من الأعداد الكمية المختلفة في ثلاث أبعاد.
إذا كنت قد فهمت هذا الجزء فأنك لابد أن عرفت لماذا كان عنوانه (بزوغ ميكانيكا الكم أو نهاية ذرة بور). هذا لأنه يتبين لنا الآن كم كانت نظرية بور مفرطة التبسيط لوصف سلوك الإلكترون رغم نجاحها على الذرات وحيدة الإلكترون. إن شكل إلكترون يدور في مدارات دائرية أو بيضاوية لم يعد صحيحا بالنسبة لنا الآن، بل كل ما يمكن أن تفعله تلك المدارات هي أن تظهر كواحدة من تلك الاحتمالات العديدة الموجودة في الشكل (5–4) عندما تتخذ أعداد الكم الأربعة فيما معينة.
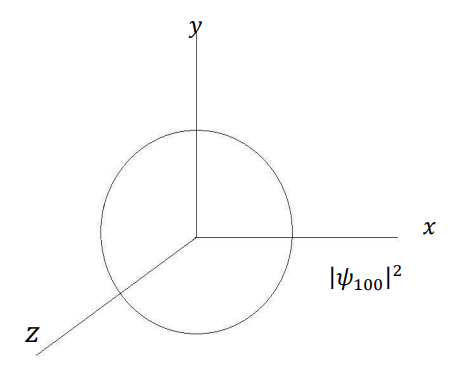
شكل (4–4)
التماثل الكروي لمربع دالة الاحتمال لإلكترون ذرة الهيدروجين في الحالة الأرضية 1 = n و0 = l و0 = m، حيث يظهر التوزيع ككرة متماثلة في كل الاتجاهات.
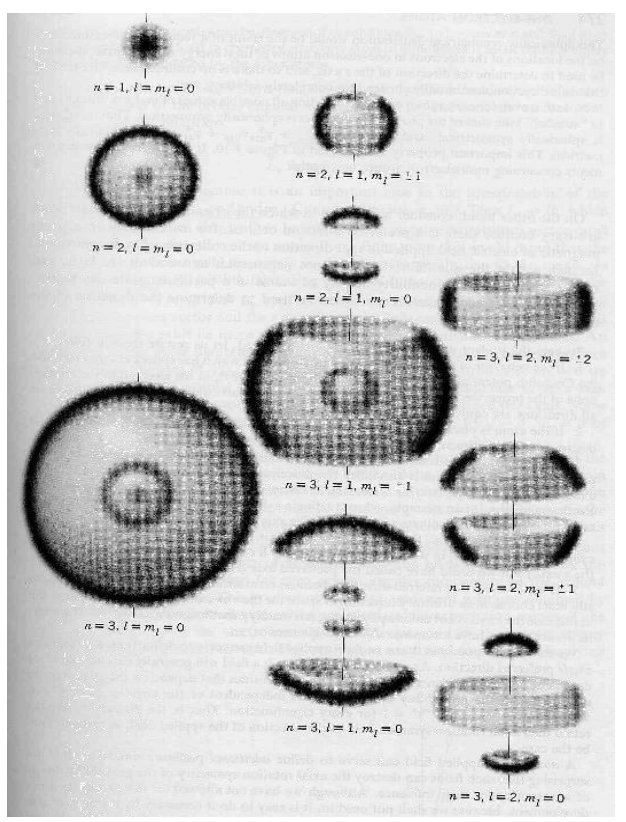
شكل (5–4)
توزيع دالة كثافة الاحتمال 2|(r ,θ, Φ)Y|. المجموعة مختلفة من أعداد الكم في ثلاث أبعاد. هنا ml = m وz هو المحور الرأسي. يجب أن تتخيل دوران الصور هنا حول المحور z، وذلك لتمثيل الشكل في ثلاث أبعاد.
____________________________
هوامش
[2] قد يكون هذا الجزء صعب بعض الشيء لمن يقرأ ميكانيكا الكم أول مرة، لذلك لا بأس بقراءته أكثر من مرة، والرجوع إلى مصادر أخرى حتى يفهم بشكل جيد.
 الاكثر قراءة في ميكانيكا الكم
الاكثر قراءة في ميكانيكا الكم
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


