
دور ميكانيك الكم Role Of Quantum Mechanics
 المؤلف:
فياض محمد شريف
المؤلف:
فياض محمد شريف
 المصدر:
علم الحياة الكمومي
المصدر:
علم الحياة الكمومي
 الجزء والصفحة:
(ص195 – ص204)
الجزء والصفحة:
(ص195 – ص204)
 2023-04-10
2023-04-10
 2756
2756
دور ذرة الزنك في الموقع الفعّال للإنزيم (شكل 7-5) هو دور تحفيزي تقليدي يعتمد على الحركة الجزيئية العشوائية.
كما أن الآليات التقليدية في تفسير عمل الإنزيم، كالاعتماد فقط على الحالة الانتقالية، يمكن أن تُسرع التفاعل بحدود مليون مرة، غير أن السرعة الفائقة الحاصلة في الواقع والسلوك الغريب لها في درجات الحرارة لا يمكن تفسيرها على أساس الآليات التقليدية، ونظرية الحالة الانتقالية تحتاج إلى تفسير آخر (2017 ,Brookes). هذا التفسير يمكن أن ينسجم مع ما ذهب إليه شرودنجر في أن «النظام ينشأ من النظام»؛ فعمل الإنزيم منظّم، يؤدي إلى منتوج متماثل في كل مرة، والإنزيم تركيب عضوي عالي التنظيم، وأي تغير بسيط في تركيبه كتغير أحد الأحماض الأمينية البعيدة عن موقع التفاعل، له تأثير مهم في عمله، ما يجعل الاعتماد على العشوائية والحالة الانتقالية وحدها غير كافٍ لتفسير عمل الإنزيم. كما لم تنجح محاولات تكوين إنزيم اصطناعي اعتمادًا على مبدأ الحالة الانتقالية، وما نعرفه من آليات عمل الإنزيم، ما يعني أننا هنا لم نفهم آلية عمل الإنزيم جيدًا؛ فعلى قول رتشارد فينمان: «الشيء الذي لا أتمكن من تكوينه يعني أنني لم أفهمه.» ما يقوم به الإنزيم هو التلاعب بالذرات والبروتونات والإلكترونات المفردة ضمن وبين الجزيئات.
وهذا يرتبط بميكانيك الكم الذي يعتمد على حالة التماسك التي تُظهر أمورًا غير عادية كالتراكب والاختراق الكمومي وغيرها، والتي تتلاشى بفك التماسك.
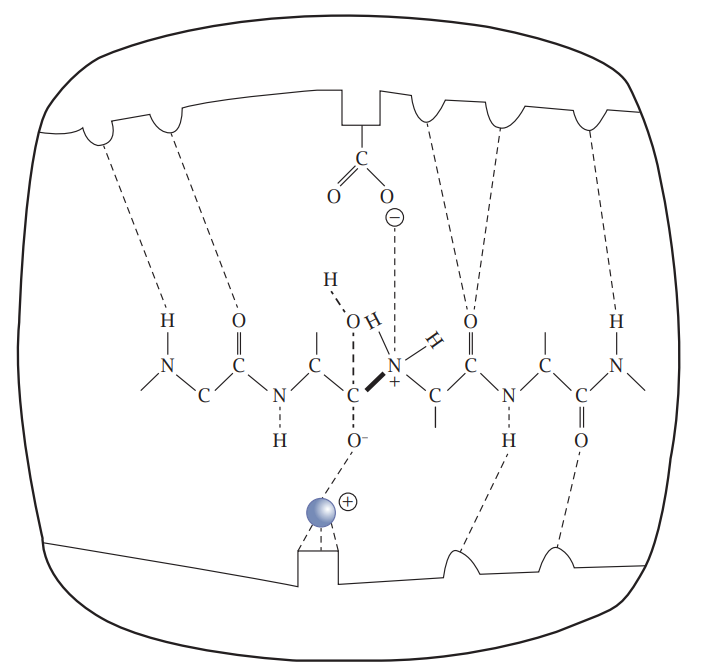
شكل 7-5: كسر الآصرة الببتيدية (بالخط العريض) للكولاجين في الموقع الفعال لإنزيم كولاجينيز. الحالة الانتقالية للمادة الأساس، موضّحة بالخطوط المتقطعة. الكرة وسط أسفل الشكل تمثل أيون الزنك الموجب. مجموعة الكاربوكسيل (COO) في أعلى الشكل هي من الحامض الأميني كلوتامات في الموقع الفعّال للإنزيم. مع ملاحظة أن الأبعاد الجزيئية لا تعبر عن الأبعاد الحقيقية. عن (2014) McFadden & Al-Khalili.
التفاعلات الكيميائية التي تتضمَّن انتقال الإلكترونات تحدث في تفاعلات الأكسدة؛ فعملية حرق الفحم في الهواء مثلا هي عملية أكسدة، يتم فيها تسخين الفحم حيث ترفع طاقة الإلكترونات، ليتم انتقالها من الفحم (كاربون) إلى ذرات الأوكسجين، لتتكون أواصر منخفضةُ الطاقة في جزيئات ثاني أوكسيد الكاربون، وفرق الطاقة يتحول إلى حرارة. في الخلايا الحية تحصل تفاعُلات الأكسدة بواسطة إنزيمات الأكسدة - الاختزال خلال عملية التنفس وغيرها.
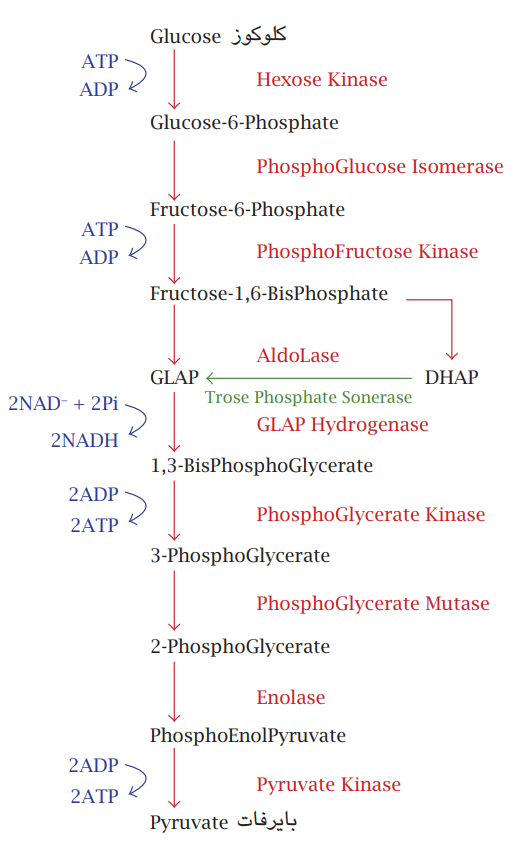
شکل 7-6: مسار التحلُّل السكَّري. يبدأ بجزيئة كلوكوز سداسية الكاربون وينتهي بالبايروفات الثلاثية الكاربون.
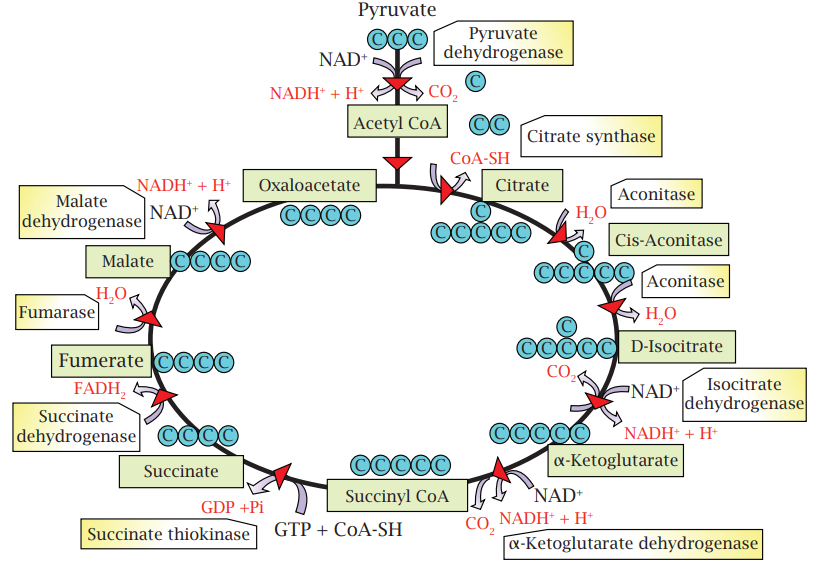
شكل 7-7: دورة كريبز تبدأ بالبايروفات، وتؤدي إلى تفكيكها وتكوين 3 جزيئات CO2 وتكوين عدد من المساعدات الإنزيمية NADH و FADH2.
عملية التنفس تحصل في جميع الخلايا الحية والغرض منها الحصول على الطاقة التي تنتج من تفاعلات الأكسدة للاستفادة منها في النمو، وتسيير الفعاليات الحيوية. المواد الأساس التي تعمل عليها هذه الإنزيمات هي المواد الغذائية خاصة السكريات والدهون التي تختزن الطاقة أصلا في الأواصر التي تربط الهيدروجين بالكاربون وذرات الكاربون مع بعضها. هذه الأواصر هي إلكترونات مشتركة بين ذرتين ضمن نفس الجزيئة. عملية التنفس تشبه من حيث المبدأ عملية حرق الكاربون، لكنها لا تتم بتفاعل واحد، وإنما بسلسلة من التفاعلات المتتالية، التي تُحفّز بواسطة إنزيمات وتؤدي إلى انتقال تدريجي للإلكترونات من مستويات طاقيَّةٍ عالية إلى مستويات طاقية منخفضة؛ حيث تستقبل من قبل إنزيمات والفروق الطاقيَّة تُستغل في تكوين مركبات خازنة للطاقة؛ هي جزيئات (Adenosine triphosphate (ATP. كما يترافق انتقال الإلكترونات مع انتقال البروتونات بواسطة المساعدات الإنزيمية المختزلة، ويكون لها دورٌ مُهم في تكوين الجزيئات الخازنة للطاقة.
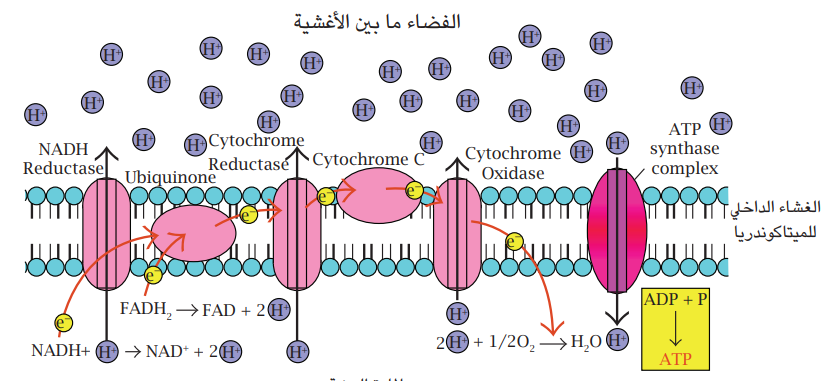
شكل 7-8 سلسلة نقل الإلكترون في الميتاكوندريا. مُحوَّر عن (1998) Gary E. Kaiser.
ثمة عدد من المسارات التنفسية المختلفة، والتي تعمل بشكل متزامن من أجل الاستفادة القصوى من الطاقة المتحررة المسار الأول ويُعرف بمسار التحلُّل السكري (Glycolysis) ويتم في السايتوبلازم تكون فيه المادة الأساس جزيئات الكلوكوز؛ وهي سكريات بسيطة سداسية الكاربون تنشط بربطها بجزيئات فوسفات من جزيئتي ATP وتمر بسلسلة تفاعُلات بضمنها تفاعلات أكسدة اختزال لتنتهي بتكوين جزيئتي بايروفات ثلاثية الكاربون، وتكوين أربعة جزيئات ATP فتكون المحصلة جزيئتا ATP وجزيئتا NADH مختزلة. التفاعلات المتسلسلة تسير بواسطة إنزيم في كل خطوة، أو وهي تحصل بوجود او عدم وجود الأوكسجين حيث لا يشترك في التفاعل. لكن ناتج التفاعل جزيئات البايروفات ستدخل مسارًا تنفسيًّا آخر؛ هو دورة كريبز (Krebs cycle) (شكل 7-7).
قبل الدخول في دورة كريبز، يتم إزالة ذرة كاربون من المركب الثلاثي الكاربون البايروفات، وتتم إزالة ذرَّتَي الكاربون الأخريين في دورة كريبز. سلسلة التفاعلات التي تسرع كل منها بواسطة إنزيم تؤدي إلى تكوين جزيئتي Guanosine triphosphate (GTP) وهي مكافئة لجزيئات ATP وعدد من جزيئات NADH وFADH2 المختزلة والتي ستدخل المسار التنفسي الثالث وهو سلسلة نقل الإلكترون (شكل 7-8) حيث تحصل تفاعلات الأكسدة – الاختزال وفيها تنقل هذه المساعدات الإنزيمية المختزلة البروتونات والإلكترونات من إنزيم إلى آخر على الغشاء الداخلي للميتاكوندريا. تقوم طاقة الإلكترونات بضخ البروتونات عبر الغشاء إلى الخارج. تدفق هذه البروتونات المتراكمة عبر الغشاء إلى داخل الخلية من خلال معقد AT synthiaser الموجود على الغشاء، سيُوفِّر الطاقة اللازمة لتكوين جزيئات ATP من جزيئات ADP ومجاميع الفوسفات. هذه الحالة مشابهة لإنتاج الطاقة الكهربائية بواسطة توربينات السدود وفي آخر المسار، يتحد زوج من البروتونات وزوج من الإلكترونات ونصف جزيئة أوكسجين لتكوين جزيئة ماء. وهكذا فإن معظم الطاقة الناتجة من عملية التنفس تنتج في مسار سلسلة نقل الإلكترون.
حسب (2014) McFadden & Al-Khalili فإن عملية انتقال الإلكترون بين جزيئة إنزيم وجزيئة إنزيم مجاور على الغشاء الداخلي للميتاكوندريا تتطلب قطع مسافة بضع عشرات من الأنكسترومات (أي بطول عدة ذرات حيث إن قُطر الذرة يتراوح بين 1 إلى 5 أنكستروم). وهي مسافة أكبر بكثير من أن تُفسَّر على أساس القفز الحراري الاعتيادي للإلكترون.
بقي تفسير هذه الظاهرة غامضًا لعدة عقود. لاحظ Britton Chance أن الضوء يُشجع نقل الإلكترونات من إنزيم السايتوكروم إلى الأوكسجين في سلسلة نقل الإلكترون. واكتشف هذا الباحث مع باحث آخر هو Mitsuo Nishimura أن هذه العملية تحدث في البكتيريا Chromatium vinosum حتى لو بردت بالنتروجين السائل إلى – 190م°. ثم قام DeVault وChance بتعريض البكتيريا إلى ومضة ضوء أحمرَ بَرَّاقِ من ليزر ياقوت، ولمدة قصيرة جدا هي 30 نانوثانية، ووجدا أن معدل نقل الإلكترون في هذه البكتيريا يستمر بالانخفاض حتى حوالي –173م° ليصل إلى 1000 مرة أقل، مقارنةً بمعدله في درجة حرارة الغرفة. وهذه نتيجة منطقية متوقعة إذا كانت عملية نقل الإلكترونات تسير أساسًا بالطاقة الحرارية. لكن المفاجأة حدثت حين خفض الباحثان درجة الحرارة إلى أقل من –173م° حيث ارتفع معدل نقل الإلكترون ووصل إلى قمة معينة، وبقي ثابتًا رغم الاستمرار في تخفيض درجة الحرارة إلى 238م°.
هذه النتيجة تبين أن آلية نقل الإلكترون في الإنزيم لا يمكن إرجاعها فقط إلى عملية قفز الإلكترون التقليدية، ويمكن أن تعتمد على ميكانيك الكم وخاصة ظاهرة التسرب الكمومي؛ فالتسرب يمكن الجسيمات الذرية من عبور أو اختراق حاجز طاقة عال (شكل 7-9) أو مادة عازلة ضيقة بين جانبي موصلين كهربائيَّين، أو كما في حالتنا التي نناقشها، فضاء بين إنزيمين في السلسلة التنفسية. الشكل 7-9 يُظهر الحالة التقليدية لعبور الإلكترون مثلا حاجز الطاقة من خلال اكتسابه مزيدًا من الطاقة، لكن ثمة إمكانية وإن كانت باحتمال صغير، أن يسلك الإلكترون كموجة ويخترق حاجز الطاقة وهو في مستوى طاقي منخفض نسبيًّا. لكن التسرب كأي ظاهرة كمومية، يتطلب أن يكون السلوك الموجي للجسيم متماسكا؛ أي إنه يكون في حالة تناغم حيث تكون الموجات متطابقة. وفور فقدان الموجات لحالة التناغم هذه يحصل فك التماسك، ويسلك الجسيم سلوكًا تقليديا كما في حالات القياس أو المراقبة أو الاتصال بالبيئة (2002 ,Zurek). وهنا تبرز مشكلة تتطلب حلًا؛ فالتفاعلات الإنزيمية تحصل عادةً في أوضاع تعج بالجزيئات المختلفة، المتحرّكة حركات عشوائية سواء داخل الخلية او خارجها.
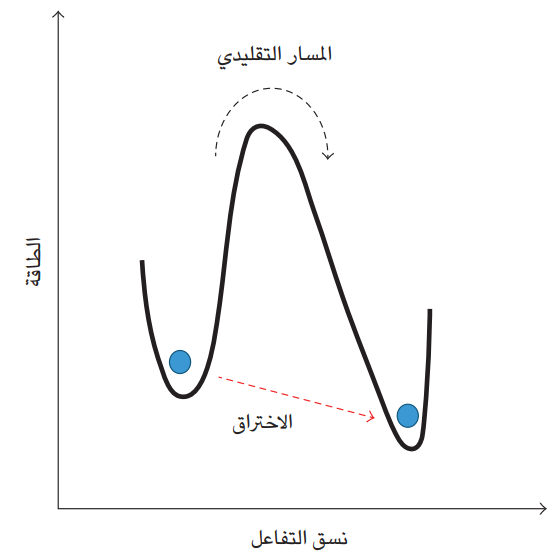
شكل 7-9: توضيح مسار الاختراق والمسار التقليدي لعبور الجسيمات الذرية مثل الإلكترون لحاجز الطاقة.
هذه الحالة تفرض حصولاً سريعًا جدًّا لفك التماسك مما لا يُبقي وقتًا كافيًا للتماسك لتحقيق انتقال الجسيمات. الحل إذن يمكن أن يكمن في الإنزيم نفسه؛ فداخل الإنزيم تنهمك الجسيمات بحركاتٍ متوافقة وليست عشوائية. كما أن الإلكترونات خفيفة جدًّا مما يسمح لها أكثر من غيرها بالاختراق، وهي بحركتها الموجية تخترق هذه الحواجز مثلما يخترق الصوت جدران الغرف مع الفارق في آلية اختراق الصوت للجدار. وحسب (2002) Knapp & Klinman فإن التأثيرات الكمومية في نقل الإلكترون في التفاعلات البيولوجية، أمرٌ مُقَر منذ مدة طويلة بسبب عدم الدقة العالية في موقع الإلكترون. كما أن الطبيعة الكمومية لنقل الإلكترون تطلَّبَت نماذج تفاعلات جديدة تتعدى نظرية الحالة الانتقالية.
وأظهرت التجارب الحديثة أن ليس الإلكترونات فقط تتمكن من الاختراق، بل البروتونات أيضًا، وهي أثقل كثيرًا من الإلكترونات (البروتون أثقل حوالي 2000 مرة من الإلكترون) بل وحتى الذرات تتمكّن من الاختراق في التفاعُلات الإنزيمية. ثمَّة سلسلة من الحركات الحرارية المتوازنة التي تسيطر على المسافة بين مانح الهيدروجين ومستقبل الهيدروجين والكهربائية المستقرة للمركز الفعّال في الإنزيم؛ مما يوفّر تكيُّفات بنيويةً مناسبة لاختراق البروتون (2009 ,.Klinman & Kohen, 2013; Bandari et al).
وكما هو معروف فإن الجسيمات الصغيرة تتمكّن من الاختراق بسهولة، لكن الجسيمات الكبيرة تجد مقاومة أكثر للاختراق ما لم تكن المسافة التي عليها اختراقها قصيرة جدًّا. وكما موضح في الشكل 7-5، فإن الإنزيمات ومنها إنزيم كولاجينيز تحرّك البروتونات لتكسر الأواصر الببتيدية. لكن تفسير هذه الحركات وهي شائعة في الإنزيمات وفي درجات الحرارة التي تعمل فيها الإنزيمات في الخلايا الحية تُعتبر عالية (بمقاييس ميكانيك الكم) ما يمكّنها من تحريك البروتونات على أساس الحركة العشوائية الحرارية، والتي لا تستدعي الاختراق لتفسيرها. كما أن انتقال البروتونات في معظم التفاعلات الإنزيمية في درجات حرارة عالية كهذه يتم من خلال القفز الحراري غير الكمومي بين الجزيئات. لكن اختراق البروتونات يحصل في عددٍ قليل من التفاعلات التي لا تكون معدلاتها متأثرةً بفروق درجات الحرارة.
ومن أجل إثبات اختراق البروتون في التفاعلات الإنزيمية استخدم (1989) ,.Cha et al التأثير الحركي للنظائر (Kinetic isotope effect) (KIE). إن KIE هي تقنية في الكيمياء الفيزيائية العضوية تعتمد على التغير في معدل التفاعل الكيميائي نتيجة استبدال ذرة في المواد المتفاعلة بإحدى نظيراتها (Isotopes) ويتم إيجاد KIE كنسبة في ثوابت التفاعل بين المادة الخفيفة KL والنظير الثقيل KH
KIE = KL/KH
التغير في معدل التفاعل هو تأثير كمومي ينتج عن أن للنظير الأثقل ترددات اهتزازية أقل من المادة الأخف. هذا يؤدي إلى الحاجة إلى طاقة أكبر لوصول النظير الأثقل إلى الحالة الانتقالية، وبالتالي انخفاض معدل التفاعل وهكذا يمكن استخدام هذه التقنية لاختبار اختراق البروتون من خلال مقارنة معدل التفاعل له مع معدل التفاعل المماثل باستخدام نظير أثقل؛ فذرة الهيدروجين مثلًا تتألف من بروتون واحد في النواة وإلكترون واحد، وهكذا فهي يمكن أن تكون أيون هيدروجين H+ متمثلا بالنواة دون الإلكترون. ويُوجد نظیران ثقيلان للهيدروجين أقل شيوعًا هما الديتيريوم D حيث تتألف نواته من بروتون واحد ونيترون واحد، كذلك التريتيوم T حيث تتألف نواته من بروتون بالإضافة إلى اثنين من النيوترونات.
من المعروف أن النظائر تتشابه في السلوك الكيميائي؛ حيث إن من يلعب الدور الرئيس في التفاعلات الكيميائية هي الإلكترونات والتي يكون عددها متماثلا في جميع نظائر العنصر. ان فرص الاختراق الكمومي تقل كلما كان الجسيم أثقل؛ وبالتالي تستخدم KIE لإثبات انتقال البروتون مثلا إذا أظهرت نتائج التجربة أن استخدام النظائر الثقيلة مثل الديتيريوم تخفض سرعة التفاعل والتعزيز النتائج ينبغي إثبات أن اختراق البروتون يحصل في درجات الحرارة المنخفضة حيث يحتفظ بقمةٍ معينةٍ. وهذا ما حصل عليه (1989 ,.Chaet al باستخدام الإنزيم Alcohol dehydrogenase في نقله للبروتون من الكحول إلى +NAD ، لينتج NADH. وعزّز باحثون آخرون هذه النتائج (2010 ,Kohen et al., 1999; Sen & Kohen). إن مؤشرات تفاعلات C – H عن طريق نقل ذرات الهيدروجين قد تبدو منسجمة مع نموذجي «تخطي الحاجز التقليدي أو تصحيح اختراق شكل الجرس». غير أن كلا النموذجين لا يتمكنان من تفسير قيم فرق طاقة التنشيط EaΔ في درجات الحرارة القريبة من الصفر المطلق في العديد من الإنزيمات؛ والتي تزداد بفعل الاضطرابات الداخلية أو الخارجية المصدر. بينما يطرح نموذج الاختراق الكمومي التام كتفسير لاعتماد KIE على درجات الحرارة، والذي يُبرز أهمية المسافة بين مانح الهيدروجين ومستقبل الهيدروجين لعمل تطابق دالة الموجة والذي تؤكّده تجارب تحديد EaΔ
.(2018 Klinman & Offenbacher)
لقد تمكن فريق من الباحثين من تطوير وسيلة اتصال بيولوجي كمومي لاختراق الإلكترون (Quantum Biological Electron Tunnelling (QBET واستخدامها في الزمن الحقيقي لكشف الاختراق الكمومي للإلكترون في سايتوكروم C للميتاكوندريا خلال حياة وموت الخلية. وبيَّنت طريقة QBET عملية الاختراق عَبر الجزيئات المعيقة على مسافات مختلفة لتقدّم إثباتًاً تجريبيا لعملية الاختراق الكمومي، وتفتح المجال لتطبيقات مهمة مختلفة (2019 ,.Xin et al). ثمة طرق كمومية أخرى؛ كالتشابك يمكن أن تفسر عمل إنزيمات أخرى، كما في حالة إنزيم Kurian et al., 2016) type II restriction endonucleases).
 الاكثر قراءة في الفيزياء الحيوية
الاكثر قراءة في الفيزياء الحيوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


