

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Ammonia synthesis
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
709-710
2025-10-19
47
Ammonia synthesis
Key point: Catalysts based on iron metal are used for the synthesis of ammonia from nitrogen and hydrogen. The synthesis of ammonia has already been discussed from several different viewpoints (Section 15.6). Here we concentrate on details of the catalytic steps. The formation of ammoniais exergonic and exothermic at 25°C, the relevant thermodynamic data being ∆fGO 116.5 kJ mol 1, ∆fHO 146.1 kJ mol 1, and ∆f SO 199.4 J K1 mol 1. The negative entropy of formation reflects the fact that two NH3 molecules form in place of four reactant molecules. The great inertness of N2 (and to a lesser extent H2) requires that a catalyst be used for the reaction. Iron metal, together with small quantities of alumina and potassium salts and other promoters, is used as the catalyst. Extensive studies on the mechanism of ammonia synthesis indicate that the rate-determining step under normal operating conditions is the dissociation of N2 coordinated to the catalyst surface. The other reactant, H2, undergoes much more facile dissociation on the metal surface and a series of insertion reactions between adsorbed species leads to the production of NH3:
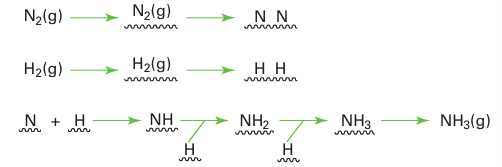
Because of the slowness of the N2 dissociation, it is necessary to run the ammonia synthesis at high temperatures, typically 400ºC. However, because the reaction is exothermic, high temperature reduces the equilibrium constant of the reaction. To recover some of this reduced yield, pressures in the order of 100 atm are used to favour the formation products. A catalyst operating at room temperature that could give good equilibrium yields of NH3, such as the enzyme nitrogenase (Section 27.13), has long been sought. In the course of developing the original ammonia synthesis process, Haber, Bosch, and their co-workers investigated the catalytic activity of most of the metals in the periodic table and found that the best are Fe, Ru, and U promoted by small amounts of alumina and potassium salts. Cost and toxicity considerations led to the choice of iron as the basis of the commercial catalyst. The role of the various promoters, particularly K, in the Fe metal catalyst had been the subject of much scientific research. G. Ertl4 found that, in the presence of potassium, N2 molecules adsorb more readily on the metal surface and the ad sorption enthalpy is made more exothermic by about 12 kJ mol−1, probably as a result of the increased electron-donating abilities of the Fe/K surface. The more strongly adsorbed N2 molecule is then cleaved more easily in the rate-determining step in the process.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















