
حمض الآزوت Nitric Acid
 المؤلف:
GEORGE T . AUSTIN
المؤلف:
GEORGE T . AUSTIN
 المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
 الجزء والصفحة:
ص 433
الجزء والصفحة:
ص 433
 4-10-2016
4-10-2016
 21176
21176
حمض الآزوت Nitric Acid :
عرف حمض الازوت واعترف بأهميته منذ امد طويل . والطريقة العادية القديمة لتحضير تقضي بتقطير النترات saltpeter مع حمض الكبريت . ويشكل البرق كميات هامة منه في الجو يمكن حرق الامونيا في الهواء بوجود محفز بلاتيني ، ويمكن اكسدة اكاسيد النتروجين المتشكلة الى حد ابعد وامتصاصها في الماء لتشكيل حمض الازوت .
ان انخفاض كلفة الامونيا جعل هذه الطريقة اقل كلفة من كلفة الطريقة القديمة بتركيبه من ملح البارود الشيلي .
الاستخدامات والاقتصاديات : يستخدم معظم حمض الازوت في تصنيع نترات الامونيوم . وتستخدم كميات اساسية منه في تصنيع النترات الاخرى ، العضوية واللاعضوية ، اضافة الى استخدامه في تصنيع مركبات النتروجين العضوية . ويجري انتاج نترات الصوديوم ، والنحاس ، والفضة على نطاق واسع. وتتضمن الاستخدامات المباشرة لحمض الازوت الحفر الفوتوغرافي ، واستخلاص الذهب والفضة .
ان ما تحتويه الصخور الفوسفاتية المستخدمة في الاسمدة من الفسفور يجعلها مفيدة للاستخدام النباتي بعد تحميضها بحمض الكبريت . والتحميض بحمض الازوت يضيف مخصبا نتروجينيا مرغوبا الى الفسفور الموجود سابقا . يتجبل سماد الازوت المحمض اثناء التخزين ، ولكن يجري بالتدريج التغلب على هذه الصعوبة، ويتوقع ان تتوسع السوق امام هذا النوع من السماد .
النترات العضوية ( نتروغليسرين ، ونترات غليكول ، ونترات السليولوز ) ومركبات النترو (TNT ، و RDX ، وحمض البكريك) تحتاج جميعها الى حمض الازوت لتركيبها . والنتروبرافينات Nitroparaffins تصنع ايضا على نطاق واسع عن طريق نترجة الطور البخاري مع حمض الازوت . وخصائص الاكسدة القوية التي يحملها حمض الازوت في المحاليل المخففة مفيدة جدا في بعض الاحيان مع انها في العادة مرفوضة جدا في التراكيب العضوية .
تصنع الاصناف التجارية من حمض الازوت لتحقيق الشروط ، وهي في العادة 36 - 42 بوميه (w / w 53.4 - 68.7 %) . يصنع الحمض ذي التركيز العالي ( 94.5 - 95.5 % ) ، والذى يعرف في السوق التجارية تحت اسم الحمض ´´ المركز " في مصانع مصممة على نحو خاص ، وهو اكثر كلفة. ويمكن تصنعه من حمض اضعف بالتقطير الاستخلاصي مع عوامل قوية مزيلة للماء كحمض الكبريت وسلفات المغنزيوم .
المواد الخام : المواد الاساسية هي : الامونيا ، والهواء ، والماء ، والمادة الحفازة من شبك البلاتين - الروديوم 10 % . ومن المرغوب فه عاده ان مكون الموقع تقريبا من احد مصانع الامونا. وبما ان 17 كغ من الامونيا ، او 105 كغ من حمض ازوث 60 % تحتوى ( كغ من النتروجين ، فقد يجد المصنعون الكبار ان نقل الامونيا اقل كلفة من نقل حمض الأزوت . وتستخدم مركبات وشاحنات الستانلس ستيل للتعامل مع محاليل حمض الأزوت .
التفاعلات وتبدلات الطاقة : اعتبرت التفاعلات التالية ذات اهمية كبيرة في تصنيع حمض الآزوت :
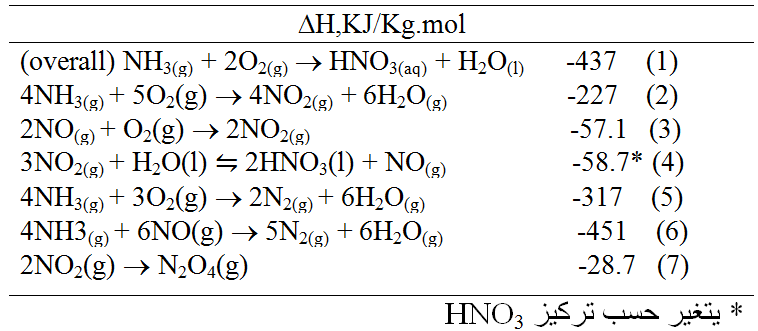
يشار الى المزائج الغازية لأكاسيد النتروجين ( NO,N2O3,NO2,N2O4 ) عادة كـ NOX بغض النظر عن التركيب .
يحتوي الحمض المصنع على بعض من حمض النيتروز (HNO2) عندما يكون التركيز بين 20-45 % HNO3 W/W و على N2O4 المنحل عندما يزيد التركيز عن 55 % ، إن إمكانية تأكسد حمض 20 – 45 % تثبت النتروجين الثلاثي التكافؤ (HNO2) ، واكثر من 55 % تثبت النتروجين الرباعي التكافؤ (, N2O4) .
التفاعل ( 2 ) تفاعل سريع ( عندما يحفز ) ، ويكتمل خلال اقل من 1 / 1000 / ثا . ولذلك يجب اجراؤه كتفاعل أدياباتي ( كظوم ) reaction adiabatic . كما يجب تحديد نسبة الامونيا في هواء التغذية بحيث لا تتلف درجة الحرارة القصوى التي يتم الوصول اليها المادة الحفازة المكلفة .
والتفاعل ( 3 ) تفاعل بطيء غازي الطور حركيته kinetics من الدرجة الثالثة وتزداد سرعته مع ارتفاع درجة الحرارة . ولكن اكتماله الى NO2 ليس عمليا من الناحية التجارية .
ويظهر التفاعل (4) عدة ملامح مزعجة على الرغم من اعتدال سرعته والانخفاض النسبي في ∆H . والاقتراب من التوازن سريع بدرجة معقولة ، لكن التوازن غير ملائم تماما . وينعكس التفاعل اذا كان تركيز الحمض عاليا او اذا كان حارا جدا . تبين الصورة ادناه توازن التفاعل ( 4 ) في التخطيط البياني اللوغاريتمي كـ (PNO/P3NO2) في الطور الغازي مقابل النسية المئوية لـ HNO3 في الطور السائل مع درجة الحرارة كدليل .
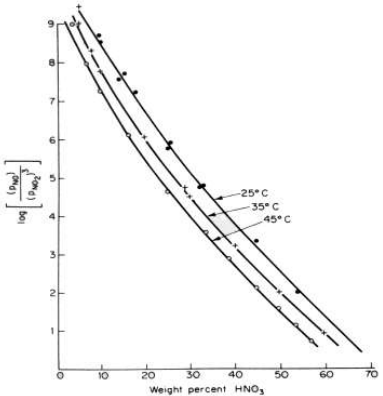
وتفاعل الامتصاص عمليا اكثر تعتيدا مما يشير اليه التفاعل (4) ، لان NO2 ، و N2O3 ، و N2O4 ، و HNO2 جميعها تمتص وتتفاعل لإنتاج HNO3 ، ولكن ثلث الغازات المنحلة يفصل بعدئذ على شكل NO ، فيحتاج الى اعادة الاكسدة وتجديد الامتصاص ، فك تبقى منه الا كمية قليلة جدا. ومن هنا نرى ان هذه الطريقة تستنزف الوقت .
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


