 المؤلف:
GEORGE T . AUSTIN
المؤلف:
GEORGE T . AUSTIN
 المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
المصدر:
SHREV ‘ S CHEMICAL PROCESS INDUSTRIES
 الجزء والصفحة:
ص 531
الجزء والصفحة:
ص 531
 4-10-2016
4-10-2016
 2251
2251
اليوريا Urea :
تعتبر اليوريا من عدة نواح هي الشكل المناسب للنتروجين الثابت . فهي تحمل اكبر محتوى ممكن من النتروجين على شكك سماد صلد ( 46 % ) . وتنتج بسهولة على شكل كريات او حبيبات وتنقل بسهولة ايضا سائبة او معبأة في اكياس بدون خوف من خطر تفجرها . وتنحل بسهولة في الماء . وهي لا تخلف ثمالة ملحية على المحاصيل بعد استخدامها ، كما يمكن استعمالها لتغذية اوراق النبات . وتضاف ، علاوة على استخدامها كسماد ، الى استعمالها الحيوانات المجترة كمادة بروتينية ، وفي انتاج الميلامين ، وكمقوم في تصنيع الراتنجات ، واللدائن ، وراتينجات التبادل الايوني . وهي منتج وسط في تصنيع سلفمات الامونيوم Ammonium sulfamate ، وحمض السلفميك sulfamic acid والفثالوثامين pthalocyamine .
الإنتاج في الولايات المتحدة كبير جدا حيث وصل الى 6.4 × 610 طنا وبسعر قدره 150 - 160 دولارا للطن المتري عام 1982 .
يشارك تفاعلان في تصنيع اليوريا . الاول ، هو تشكل كربونات الامونيوم تحت الضغط عن طريق التفاعل بن ثاني اكسد الكربون والأمونيا :
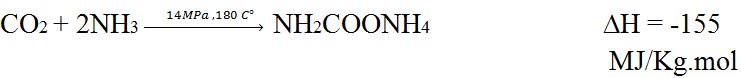
يلي هذا التفاعل الذى ينشر الحرارة بدرجة كبيرة تفاعل ماص للحرارة تتحلل فيه كربمات الأمونيوم Ammonium carbamate الى يوريا :
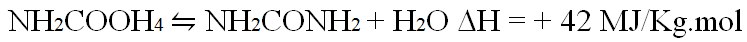
وكلاهما تفاعلا توازن . ويمضي تفاعل التشكل الى الاكتمال الافتراضي ضمن الظروف العادية للتفاعل . اما تفاعل التحلل فأقل اكتمالا . لذلك متوجب استعاد ٠ الاجزاء الثي لم تتحول من ثاني اكسد الكربون والامونيا والكريمات لاستخدامها من جديد ، وهي خطوة صعبة . ويزداد التركيب تعقيدا مع تشكل ديمر dimer يدعى البيوريت biurite NH2CONHCONH2.H2O ، يجب ان تبقى نسبته ضئيلة لأنه يؤثر بصورة عكسية على نمو بعض النباتات .
جرى مرة تجريب التشغيل بأمونيا لا متحولة فتحولت الى مركبات أمونيومية . لكن هذه الطريقة مكلفة جدا في الوقت الحاضر ، واسواق النواتج الثانوية غير ثابتة . اقيمت مصانع لإعادة الدوران جزئيا او كليا ، ولكن ما يدرس اليوم هي مصانع اعادة الدوران الكلي .
يعمل المصنع التقليدي على تحلل الكربامات في واحد او اكثر من اجهزة التحلل ، ويكون الضغط في كل منها اقل من الضغط في الذي قبله . يجب اعادة ضغط كل الغازات المنطلقة الى ضغط المفاعل reactor ، ولكنه اجراء مكلف .
اما الطريقة الاكثر شيوعا في الوقت الحاضر فقد صممت لتقليص استخدام الطاقة عن طريق " انتزاع " السائل الناتج بتلامسه مع ثاني اكسيد الكربون الداخل واستخدام بعض الحرارة الناتجة من تشكل الكربمات لإحداث التحلل الماص للحرارة والباقي منها لتوليد بخار المعالجة . وتبين الصورة 1 - 1 خط الانتاج في هذه الطريقة .
تجتمع الامونيا السائلة ، وثاني اكسيد الكربون الغازي ، والمواد المعادة الى الدوران في مبادل - مفاعل حراري بضغط 14 MPa وحرارة 170 - 190 مئوية لتشكيل الكربمات ونقل حرارة التفاعل كبخار مفيد للمعالجة .
التفاعل الذي يحدث فيه تحلل الكربمات بطيء وماص للحرارة . يجري مزيج المتفاعلات reagents التي لم تتفاعل والكربمات الى جهاز التحلل . تبلغ نسبة التحول الى حوالي 55 % عند نسب ستكيومترية لـ NH3 / CO2 ولكن مع استخدام زيادة من CO2 ( او NH3 ) ، يمكن رفع التوازن الى 85 % ولا بد من تسخين المفاعل لإجبار التفاعل على التقدم .
ويظهر مخطط سير الانتاج جهاز تحلل يليه جهاز انتزاع CO2 ، ويكون الضغط فيهما متماثلا ، بحيث لا نحتاج الى اعادة انضغاط الغاز ، بل الى مضخة صغيرة لإعادة تدوير السائل فقط .
ولازالة كافة الغازات التي لم تتفاعل والكربمات التي لم تتحلل من الناتج ، لابد من تسخين اليوريا بضغط منخفض 400 Kpa . ويجري تفعيل المتفاعلات وضخها من جديد الى الجهاز . اما الناتج النهائي فينتج بعد التبخير والتكوير او التحبب . وعموما ، يتحول اكثر من 99 % من CO2 و NH3 الى يوريا ، الامر الذي يقلل من المشاك البيئية .
الكربمات اكالة جدا للثنية العادية ولآنية الستانلس ستيل ، ولكن مع وجود الاكسجين ، قاومها سلاسل مركبات ستانلس ستيل 300 بصورة جيدة ، وعلى هذا يتم ادخال بعض الهواء اضافة الى CO2 للتخفيف من تأكل الجهاز .
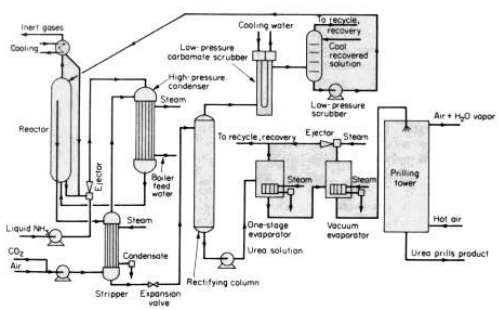
الصورة 1 - 1. مخطط مبسط لانتزاع اليوريا بطريقة ستاميكربون Stamicarbon
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


