
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
التاريخ الحديث للذرات
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 1037
10-7-2016
6086
التاريخ الحديث للذرات
على الرغم من وجود الكثير من التكهنات حول الذرة، إلا أن الأمر استدعى الانتظار حتى عام 1911 حيث أقر النموذج النووي للذرة، فقد تمكن في ذلك العام العالم أرنست رذرفورد ومعاونوه من إجراء التجربة الموضحة تخطيطياً في الشكل ((1. وقد استخدم الجسيمات المنبعثة من عنصر الراديوم المشع كقذائف. وكانت تلك الجسيمات ــ جسيمات ألفا (α)، وهي ما تعرف الآن بأنها نوى ذرات الهليوم. لقد صوبت حزمة تلك الجسيمات نحو غشاء رقيق من الذهل لم يكن سمكه يزيد على بعض مئات من الذرات.
وقد توقع رذرفورد النتيجة المبينة في الجزء (أ)، فكما تخترق الرصاصات لوحاً من الورق المقوى، فإن المتوقع أن تقوم الذرات بإبطاء الجسيمات أو قد تسبب لها انحرافاً طفيفاً. على أن النتيجة بدلاً من هذا كانت كما يوضح الجزء (ب) من الشكل : على الرغم من أن معظم الجسيمات لم يسبب لها الغشاء أي انحراف، فإن عدد قليلاً جداً منها فد انحرف بشدة كما لو كانت قد ارتطمت بجسم ضئيل للغاية ولكنه ثقيل جداً نفس الوقت. وقد اشتغل رذرفورد هذه المشاهدات ووضع المفهوم الحديث حول الذرة وهو ما يعرف بالذرة النووية.
توجد عند مركز الذرة نواة ضئيلة جداً: حيث يبلغ نصف قطرها نحو 10-15 m ويرتكها فيها نحو 99.9 بالمائة من كتلة الذرة. وتحمل النواة شحنة موجبة مقدارها Ze، حيث e هي القيمة المطلقة لشحنة الإلكترون ، أما Z فهي العدد الذري للعنصر المعنى، وهو يساوي عدد البروتونات داخل النواة (Z = 1 للهيدروجين و 2 للهليوم، و 3 لليثيوم، وهلم جراً). ونصف قطر الذرة يقترب من 40,000 مرة قدر نصف قطر النواة ولذلك فإن النواة هي في الحقيقة نقطة ضئيلة عند مركز الذرة. ويدور Z إلكترون في الفضاء الرحب للذرة خارج النواة وهي تحمل من الشحنة ما مجموعة -Ze وبهذا تكون الذرة متعادلة كهربياً. وقد أصبحنا حالياً نعرف أن الطبيعة الموجية للإلكترون تغلب على طبيعته الجسيمية فيما يتعلق بتحديد الخواص الفيزيائية للذرة، وكما نرى فإن حجم الذرة هو في الغالب خاوٍ.
وأبسط الذرات جميعاً، ذرة الهيدروجين التي تتكون من بروتون منفرد هو بمثابة النواة وإلكترون منفرد، والنموذج المبين في الشكل ((2 يتفق مع نتائج رذرفورد فالإلكترون يدور حول النواة، وتقوم قوى كولوم للتجاذب المؤثر عليه من جانب النواة بتحقيق قوة الجذب المركزي المطلوبة. على أن مثل هذا النموذج لابد أن يؤدي دور هوائي موجات كهرومغناطيسية لأنه كثيراً ثنائي قطب متذبذب. فإذا قام بهذا الدور فإن الذرة لابد أن " تتهاوى" عندما تفقد طاقة بالإشعاع، ومن ثم يتحرك الإلكترون في مسار حلزوني إلى أن يصطدم بالنواة. إلا أن ذرات الهيدروجين لا تسلك هذا المسلك، إذ إنها ــ في العادة ــ لا تشع طاقة، ولا يبدو عليها مطلقاً أنها تفنى ومعنى هذا أن النموذج المطروح لابد أن يكون خاطئاً بشكل أو بآخر.

الشكل (1): قذف رذرفورد جسيمات a عبر غشاء رقيق من الذهب. (أ) التنبؤ الأصلي لما يمكن أن يحدث. (ب) المفهوم المطلوب لتفسير النتائج التجريبية.
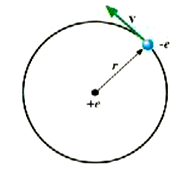
الشكل (2): النموذج الكلاسيكي لذرة الهيدروجين. ويصور الإلكترون على أنه يتحرك في مدار دائري حول النواة ذات البروتون الوحيد.
على أن ذرات الهيدروجين قد يمكن حثها على إطلاق إشعاع تحت ظروف معينة وقد ثبت لسنين عديد قبل 1900 أن الغازات بل وحتى الجوامد المتبخرة يمكن جعلها تشع ضوءاً (أي يمكن استثارة ذراتها) وذلك بإمرار شرارة كهربية أو تفريغ جهد مرتفع خلالها. (غاز النيون المستعمل في الإعلانات ــ مثلاً ــ يشع ضوءاً أحمر عند حدوث تفريغ غازي بواسطة قطبي جهد مرتفع عند طرفي الأنبوبة). ويمكن دراسة الأطوال الموجية للضوء المنبعث من هذه الغازات الساخنة، أي طيفها باستخدام إسبكترومتر (مطياف).
لقد تم قياس الخطوط الطيفية المنبعثة من كثير من الذرات بالتفصيل حتى قبل عام 1900. على أن العلماء ــ لعدم معرفتهم بتركيب الذرات ــ لم يكونوا قادرين على تقديم تفسير ذي معنى لتلك الأطياف. قذرات الهيدروجين مثلاً، وليس Hz لها أبسط الاطياف حيث يتكون الجزء المرئي من الطيف المنبعث للهيدروجين من سلسلة خطوط الطيف التي يوضحها الشكل (3). ولم يتيسر رؤية الخطوط الواقعة في المنطقة فوق البنفسجية من الطيف إلا بواسطة الصورة الفوتوغرافية ــ بالطبع ــ لأن العين البشرية غير قادرة على إبصار الموجات فوق البنفسجية.
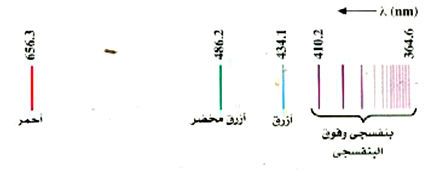
الشكل (3:( سلسلة بالمر للخطوط الطيفية للهيدروجين.
يلاحظ في الطيف أن الخطوط تتقارب مع بعضها كلما قل الطول الموجي، وأنه لا توجد خطوط ذات طول موجي أقصر من = 364.6 nmλ، حيث يسمى أقصر طول موجي في السلسلة حد السلسلة. ولابد أن هناك عدداً لانهائياً من الخطوط في هذه السلسلة وذلك حسب النظرية التي سنعرضها بعد قليل. لقد تمت التفرقة بين نحو 40 خطاً؛ أما الباقي فهم من التكدس بحيث تصعب رؤية كل خط على حدة بوضوح .
وحيث أن خطوط الطيف تبدو ذات نمط وترتيب محددين، فإنه من الطبيعي أن نحاول صياغة قانون تجريبي ينتظم هذه الأطوال الموجية. وقد تم عمل هذا لأول مرة بواسطة بالمر عام 1885 تقريباً وأصبحت تلك السلسلة تعرف باسم سلسلة بالمر. لقد وجد أن الأطوال الموجية للخطوط يمكن التعبير عنها بالمعادلة الملحوظة البساطة:
(1) 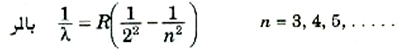
حيث R = 1.097×107 m-1 ويسمى ثابت ريدبرج تخليداً لأسم الرجل الذي عين قيمته وتؤدي الأرقام الصحيحة بدءاً من 3 إلى ما لانهاية إلى قيم الاطوال الموجية لخطوط سلسلة بالمر المبينة في الشكل (3). وعندما نضع n مساوية لما لانهاية فإن المعادلة تؤدي إلى حد السلسلة 364.6 nm.
وقد اكتشف فيما بعد أن ذرات الهيدروجين تنبعث منها سلاسل من الأطوال الموجية خلاف تلك التي تتضمنها سلسلة بالمر، حيث تقع سلسلة ليمان في منطقة الموجات فوق البنفسجية البعيدة، وتقع سلسلة باشن في المنطقة دون الحمراء (الشكل 4))) وتخضع هذه السلاسل لمعادلات تشبه كثيراً معادلة سلسلة بالمر:

الشكل (4(: السلاسل الطبقية الثلاث ذات الاطوال الموجية الأقصر والتي تنبعث من ذرات الهيدروجين.
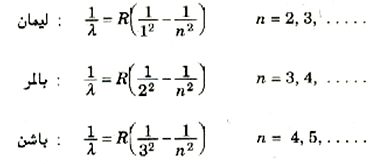
وهلم جراً . . . حيث R = 1.0974×107 m-1 ،وهو نفس المقدار الثابت لكل سلسلة.
من الواضح أنها أكثر من مجرد مصادفة، أن تنطبق مثل هذه المعادلات البسيطة على ظاهرة معقدة كانبعاث الضوء، ولابد أن هناك بساطة هائلة في سلوك الذرات، وهي المسئولة عن ظهور هذه المجموعة المتميزة من العلاقات.
ثم ابتكر نيلز بوهر عام 1912 ــ حيث كان طالباً من الدانمارك يقضى عاماً في منحة ما بعد الدكتوراه في معامل رذرفورد بإنجلترا ــ أول تفسير مقبول لطيف الهيدروجين وقد بدأ بوهر بالنموذج الكلاسيكي في الشكل ((2، ولكي يلتف حول المشكلة المرتبطة بحقيقة أن هذا النموذج يتنبأ بإشعاع كالذي يحدث بالهوائي، فقد تقبل ببساطة حقيقية أن بعض المدارس المستقرة المعينة، يمكن للذرة أن تظل فيها بلا إشعاع. على أن سبب حدوث هذا الامر لم يكن واضحاً بالنسبة لبوهر وإن كان قد جعله قادراً على يبان كيفية صدور خطوط طيف الهيدروجين المشاهدة عملياً.
وعلى الرغم من أهمية نظرية بوهر وقت ظهورها، من حيث كونها ملهمة ودليلاً للباحثين الذين توالوا بعد ذلك، إلا أنها أزيحت وتتلخص أكبر عيوبها في أن فرض بوهر الجسور حول وجود مدارات مستقرة لم يدعمه أي تفسير لسبب وجودها. . لقد أمكن تقديم هذا التفسير عام 1923 عندما اكتشف دي برولي أنا الإلكترون خواصاً موجية. ولهذا سنقفز إلى الأمام في التاريخ ونقدم وصفاً لنموذج مبكر لذرة الهيدروجين ثم الاستعانة فيه بالطبيعة الموجية للإلكترون. وسنطلق عليه النظرية شبه الكلاسيكية للذرة. وعلى الرغم من أن المعالجة الصحيحة للذرة باستخدام ميكانيكا الكم قد أزاحته جانباً.
 الاكثر قراءة في الفيزياء الذرية
الاكثر قراءة في الفيزياء الذرية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















