قياس وظيفة الغدة الصماء
يمكن التعرف على أهمية الغدة الصماء داخل الجسم من خلال ما تفرزه من هرمونات وأثرها على تنظيم العمليات الحيوية المختلفة بعدة طرق يمكن تلخيصها كم يأتي:
1- إزالة الغدة المطلوب التعرف على وظيفتها وأثرها على الوظائف الحيوية:
قديماً كانت تستخدم هذه الطريقة عندما يراد التعرف فيما أي عضو داخل الجسم يمكن أن يكون غدة صماء عن طريق:
* استئصال العضو من الجسم أو تثبيط نشاطه كيميائياً.
* تتم ملاحظة ما يطرأ على الجسم من تغيرات بسبب هذا الاستئصال أو التثبيط إيجاباً كان أم سلباً.
* يضاف اعضو أو مكوناته إلى الجسم ثانية وملاحظة ما يطرأ.
فإذا رجعت حالة الجسم إلى ما كان عليه قبيل الاستئصال يتم الاستنتاج بأن ذلك العضو هو غدة صماء. هذه الطريقة بالرغم من أنها تفضي ببعض المؤشرات الدالة على وجود الغدة الصماء فلا يمكن الاعتماد على نتائجها بسبب التداخل الذي يطرأ على الجسم نتيجة للمضاعفات الجانبية الأخرى التي قد لا تكون لها علاقة بالغدة التي تحت الدراسة. استئصال الغدة الدرقية "Thyroidectomy" مثلاً يؤثر تأثيراً مباشراً على معدل استخراج الطاقة فإن التغيرات التي تحصل بسبب الإزالة قد ينتج عنها مضاعفات أخرى بسبب مشاركة أعضاء أخرى في الوظيفة.
2- التحليل البيولوجي (biological Assay)
يعتمد هذا التحليل بشكل أساسي على ملاحظة التغيرات التي تطرأ على وظيفة الغدة الصماء فمثلاً قياس معدل نمو الخصيتين يشير إلى مستوى نمو النشاط الجنسي في الذكر وقياس حجم الغدة الكظرية يشير إلى دورها في الاستجابة للإجهاد ونمو الجسم وكبر حجمه يشير إلى وظيفة النخامية وغيرها.
يعتري هذه الطريقة أيضاً الكثير من العيوب بسبب عدم كفاءتها ودقتها في تحديد المسئول عن إحداث الوظيفة المحددة فمثلاً نمو الخصيتان والتغير في حجم الكظرية وزيادة نمو الجسم وغيرها من الأمثلة ظواهر متداخلة تتأثر وتؤثر بطرق فسيولوجية متغيرة ومتداخلة. حيث هناك عدد من الهرمونات والإفرازات الاخرى التي لها علاقة بهذه الوظائف والتي لا يمكن لهذه الطريقة تحديدها. وبالتالي فإن هذه النظام يعيب عليه عدم الدقة والحساسية في قياس نشاط الغدة الصماء.
3- التحليل الكيميائي (Chemical Assay)
وهي طريقة من طرق تحليل نشاط الغدة الصماء يعتمد فيها على قياس مركبات كيميائية لها علاقة بنشاط الغدة الصماء. فمثلاً يقاس حامض الأسكوربيك على أنه المؤشر على نشاط الغدة الكظرية، والتايروسين او اليود على نشاط الغدة الدرقية والكوليسترول على نشاط الهرمونات الستيرويدية والحليب الحوصلي على نشاط البرولاكتين في الحمام. والأمثلة على ذلك كثيرة ومتعددة.
هذه الطريقة لم تعد من الطرق المعتمدة في تحليل نشاط الغدة الصماء بسبب عدم حساسيتها ودقتها في تحديد المسئول المباشر على نشاط الغدة ووظيفتها بسبب التداخل والوظيفي للغدد الصماء وكذلك الهرمونات التي تفرزها.
4- قياس البروتين الرابط للهرمون (Competitive Protein binding Assay):
عدد من الهرمونات من بينها الهرمونات الدهنية وهرمونات الدرقية وهرمونات الكظرية ترتبط مباشرة بعد إفرازها ببروتينات خاصة وذلك لنقلها في الدم وحمايتها من التحلل الكيميائي والإنزيمي لحين الحاجة والاستفادة منها بشكل حر.
استغلت هذه الظاهرة وتم قياس تركيز هذه البروتينات (الجلوبيولين الرابط للثايروكسين بالنسبة لهرمونات الدرقية Thyroxine binding globulin, TBG والترانسكورتين Transcortin بالنسبة للكورتيزول ... وغيرها) للتعبير عن أثر الهرمونات الرابطة لها على الوظائف التي تنظمها.
هذه الطريقة أيضاً لم تعد دقيقة لقياس نشاط الغدة الصماء وذلك لأن النشاط الحيوي للهرمون يتم وهو في شكل حر غير مربوط مع البروتين بالإضافة إلى عدم حساسيتها ودقتها في التعبير عن النشاط المباشر للغدة المراد معرفة نشاطها.
5- قياس المستقبلات (Receptor Assays):
تتلخص فكرة هذا النوع من التحليل في قياس عدد المستقبلات ونوعها الموجودة على الخلية كقياس لتركيز الهرمون ونشاط الغدة. إلا أن نوع وعدد المستقبلات الموجودة على خلايا الجسم تختلف حسب نوع الخلية ووظيفتها بسبب الاختلاف في أثر الهرمون على الخلايا المستهدفة. فمثلاً هرمون التستستيرون يؤثر مباشرة على خلايا الخصية لأجل تحفيز النشاط الجنسي في الذكر ويقوم أيضاً بتحفيز تكوين البروتينات التركيبية اللازمة لتكوين عضلات الجسم في الذكور. هرمون الثايروكسين قد يحفز الميتوكوندريا لتصنيع المزيد من الطاقة وقد يحفز أيضاً خلايا الكبد لتزويد الجسم بمزيد من الجلوكوز والأمثلة كثيرة.
وبالتالي فإن قياس المستقبلات بهذه الطريقة لا تؤدي إلى نتائج دقيقة بسبب الاختلاف الظاهر في وظيفة الهرمون المتعلقة بالمستقبل الموجود على الخلية.
6- التحليل المناعي الإشعاعي Radio immune assay (RIA))
بسبب العيوب التي ذكرت في الطرق السابقة وعدم كفاءتها في قياس التركيزات المنخفضة من الهرمونات التي تفرزها الغدد الصم بشكل دقيق وعدم مقدرتها أيضاً على تكرار الحصول على نفس النتائج لو أعيدت التحاليل في نفس المختبر او خارجه واحتياجها إلى أحجام كبيرة من العينات والوقت الطويل لمعرفة النتائج إلى جانب أنها مكلفة، قام العالم (Yalow & Berson) في عام 1968 باكتشاف نظام جديد لتحليل الهرمونات التي تفرزها الغدد يمتاز بمقدرته تحسس التركيزات المنخفضة للهرمون بشكل دقيق ومحدد بالإضافة إلى كفاءته في تكرار الحصول على نفس النتائج داخل المختبر الواحد أو حتى فيما بين المختبرات. ولقد أطلق على هذا النظام بالتحليل المناعي الإشعاعي للهرمونات (RIA). منذ اكتشاف هذا النظام تطور علم الغدد الصم بشكل سريع ومذهل وتم التعرف على العديد من الغدد الصم والهرمونات وحددت وظائفها بشكل أكثر وضوجاً. ومن أهم ما يتميز به هذا النظام:
أ) الحساسية (Sensitivity): وهي مقدرة النظام على تحسس التركيزات المنخفضة (نانوجرامات أو أقل) من الهرمونات في الدم.
ب) الخصوصية (Specificity): وهي مقدرة النظام على قياس الهرمون المراد تحليله دون غيره.
ج) الدقة (Accuracy): مقدرة النظام على قياس الكمية الحقيقية للهرمون في السائل الفسيولوجي بشكل تكراري عندما تضاف كمية معروفة من الهرمون (Recovery).
د) الكفاءة (Precision): مقدرة النظام على الحصول على نفس التركيز للهرمون من تحليل إلى آخر وتسمى أيضاً (Reproducibility) بمعنى مقدرتها الحصول على تركيز تقارب للهرمون إذا أعيد تحليله العديد من المرات داخل التحليل الواحد أو فيما بين التحاليل.
أساسيات التحليل المناعي الاشعاعي (RIA)
للتعرف على أهمية التحليل المناعي الاشعاعي للهرمون وتفهم آلية عمل هذا النوع من التحليل بشكل دقيق نرى أنه من المفيد التعرف أولاً على مكونات هذا النظام والتي تتمثل أساساً في 3 عناصر أساسية: الهرمون المواد تحليله (H) Antigen,، الجسم المضاد الخاص بهذا الهرمون Anti – body, (AB) والهرمون المشع المناظر للهرمون المراد تحليله Antigen, (H*).
تتلخص الفكرة في إتاحة الفرصة بين الهرمون غير المشع (المراد تحليله ومجهول التركيز) والهرمون المشع (نظير الهرمون غير المشع والمعروف تركيزه من خلال كمية الاشعاع) في التنافس والارتباط على مواقعهما على الجسم المضاد الخاص بهما آخذين في الاعتبار أن الفرصة متساوية بينهما بسبب تشابه الهرمونيين من الناحية الوظيفية. وجود العنصر المشع على أحداهما يسهل تتبع ارتباطه مع الجسم المضاد كدلالة غير مباشرة على ارتباط الهرمون غير المشع (المجهول) بالجسم المضاد.
في العادة، يتم تحديد كمية الهرمون المشع التي يجب ان تضاف للجسم المضاد للهرمون المراد تحليله وذلك بتحديد نسبة الارتباط التي يستطيع من خلالها معرفة نسبة الهرمون المرتبط للجسم المضاد من الهرمون غير المرتبط وعادة ما تحدد النسبة فيما بين 60 – 50% يصمم التحليل على هذا الأساس بحيث تتاج الفرصة للهرمونين (المشع وهو معروف كميته المضافة) وغير المشع (وهو المجهول والمراد تحديد كميته). كلما زاد تركيز الهرمون غير المشع كلما انخفضت نسبة ارتباط الهرمون المشع (تنخفض قراءة الاشعاع أو تنخفض نسبة الارتباط عن 50%) وكلما انخفض تركيز الهرمون غير المشع كلما زاد نسبة ارتباط الهرمون المشع على الجسم المضاد (شكل 1):
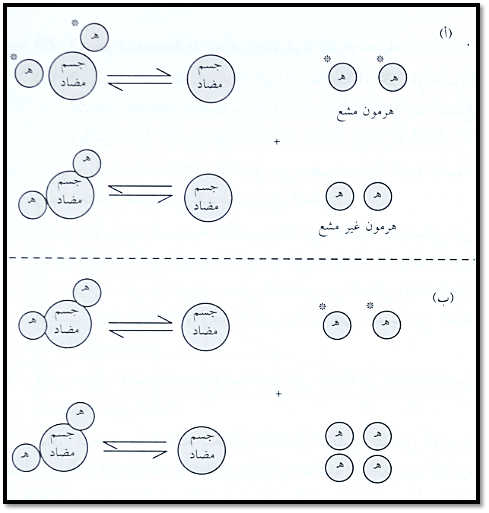
شكل (1) (أ) تنافس متساوي بين الهرمون المشع وغير المشع على الجسم المضاد (ب) زادت نسبة ارتباط الجسم المضاد بالهرمون غير المشع بسبب زيادة تركيزه.
يتخلص نظام التحليل في 4 مراحل متتابعة:
أ) تحضر المكونات الأساسية للتحليل وهي:
(1) الهرمون المراد قياسه سواء كان معروف التركيز كما في تحضير المنحني القياسي (Standard curve) أو مجهول كما في العينة المراد قياسها ويرمز له (هـ).
(2) الجسم المضاد (AB) الخاص بالهرمون المراد تحليله.
(3) الهرمون المشابه للهرمون المراد تحليله (ولكن في صورة مشعة) وعادة ما يستخدم I125 وبذلك يسمى الهرمون المشع ويقاس نشاط الإشعاع بواسطة جهاز "جاما" ويرمز له (هـ*).
ب) السماح للمكونات الثلاثة بالتفاعل مع بعضها بعضاً لفترة حضانة زمنية تختلف حسب نوع الهرمون ونوع التحليل.
ج) فصل الهرمون المرتبط (المربوط) في الجزء المتبقي في الأنبوبة (الراسب) من الهرمون الذي لم تتح له فرصة الارتباط (الحر) في الجزء السائل من العينة. بمعنى التخلص من السائل وابقاء الجزء الراسب داخل الانبوبة أو ربما العكس وذلك على حسب نوع المادة الفاصلة المستخدمة.
د) قياس معدل الاشعاع (عدد الاشعاعات لكل دقيقة) في الجزء الراسب باستخدام جهاز "جاما".
يمكن التحقق من النتائج بتحضير المنحني القياسي لتحليل الهرمون المراد معرفة تركيزه وذلك باستخدام تركيزات محددة من الهرمون تبتدئ من عينة تسمى بعينة الصفر (لا تحتوى على الهرمون) وتتدرج غلى تركيز متوقع أن لا يتجاوزه الهرمون المراد قياسه في العينة (شكل 2).
من (شكل 2) يتضح أنه إذا أضيف 5 نانو جرام /ملليلتر في المحلول من الهرمون غير المشع الذي يحتوي على الجسم المضاد والهرمون المشع فإن نسبة الارتباط بالجسم المضاد (نسبة النشاط الاشعاعي للهرمون) تصل إلى 60%، وإذا زادت هذه القيمة إلى 10 نانوجرام/ ملليلتر فإن نسبة النشاط الاشعاعي تنخفض إلى 40%، وإذا زادت إلى 15 نانوجرام/ملليلتر ينخفض إلى 20% وهكذا كلما زاد تركيز الهرمون داخل العينة كلما انخفضت نسبة ارتباط الهرمون المشع بالجسم المضاد.
من خلال تأسيس هذا المنحنى يمكن إدخال العينات المجهولة في التحليل وقياس نسبة الاشعاع (نسبة الارتباط للهرمون المشع (هـ*) فيها. فإذا قرأت العينة 40% فإن تركيز الهرمون فيها سيكون 10 نانوجرام/ملليمتر وإذا قرأت 60% فإن التركيز سيكون أقل من ذلك (5 نانوجرام) وإذا قرأت 20% فإن التركيز سيكون أعلى من ذلك (15 نانوجرام) وهكذا.
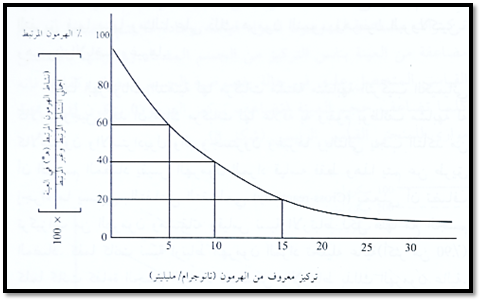
شكل 2: المنحني القياسي للهرمون باستخدام (RIA)
- التحليل المناعي الانزيمي (Enzymatic Legend Immuno assay ELISA):
وهي من الطرق الحديثة المستخدمة في قياس الهرمونات في السوائل الجسمية وتتميز بكفاءتها العالية في التحليل. تشابه إلى درجة كبيرة التحليل المناعي الإشعاعي (RIA) التي سبق ذكرها من حيث إجراءات التحليل وقياس جودة التحليل وكذلك برهنت على مقدرتها في الحصول على نتائج متقاربة جداً لتركيز الهرمون المقاس بنظام RIA. يختلف هذا التحليل عن RIA في أنه يستخدم إنزيماً خاصاً بالهرمون المراد قياسه بدلاً من الهرمون المشع وتعطى الفرصة للهرمون المقترن بالإنزيم مع الهرمون غير المقترن (المجهول) للتنافس مع الجسم المضاد الخاص بهذا الهرمون.
يقاس معدل الارتباط في هذا النظام باستخدام الانعكاس الضوئي عن طريق قياس طول الموجات الضوئية للمركب المتكون.
تستخدم هذه الطريقة في هذه الأيام بشكل تجاري واسع في مختبرات تحليل الدم في المستشفيات والمصحات والعيادات وكذلك المختبرات الدراسية وذلك من أجل نفادي مخاطر استخدام النظائر المشعة.
8 - طرق قياس معدل إفراز الهرمونات من الغدد الصم
(Measurements of Hormone secretion rate):
تقدم الغدة الصماء بإفراز الهرمون بشكل منتظم داخل الدم وأن معدل هذا الإفراز في الحالة العادية يجب أن يماثل كمية الهرمون المستخدم. ولتحديد أهمية الغدة الصماء في تنظيم الوظائف المختلفة داخل الجسم يتطلب معرفة معدل وكمية ما تفرزه هذه الغدة من الإفرازات الهرمونية ومعرفة الوقت الذي يستغرق الهرمون منذ إفرازه وانتقاله في الدم حتى أداء وظيفته والتخلص منه خارج الجسم. من خلال التجارب السابقة يمكن إيجاز طريقتين يمكن استخدامهما لنفس الغرض (حسب الظروف المتاحة) لقياس معدل إفراز هرمون غدة صماء.
1. طريقة استخدام معدل اختفاء الهرمون المشع
Radioactive hormone Turnover
تتلخص هذه الطريقة في :
1ـ حقن الحيوان بجرعة محددة من الهرمون المشع (عادة ما يستخدم I125) للغدة المراد قياس معدل افرازها من هذا الهرمون.
2- سحب عينة دم من الحيوان على فترات متفاوتة بعد عملية الحقن.
3- وضع كل عينة يتم سحبها في جهاز "الجاما" لقياس نشاط الاشعاع المصاحب للهرمون المحقون. وبالطبع فإن قراءة الاشعاع ستنخفض مع كل عينة (شكل 3).
4- وضع القراءات في منحني يربط العلاقة بين النشاط الإشعاعي للهرمون ووقت سحب العينات بعد الحقن.
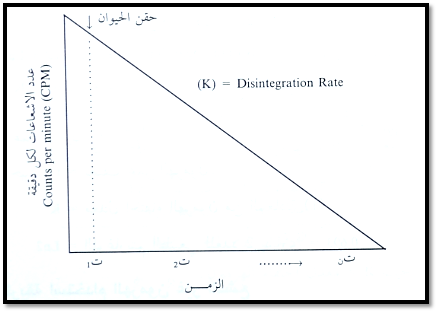
شكل 3: قياس معدل إفراز الغدة باستخدام النظائر المشعة
5- يتم قياس معدل إفراز الغدة من خلال حساب معدل اختفاء الاشعاع المرتبط بالهرمون والذي يطلق عليه بمعدل التحلل أو معدل الاختفاء أو معدل استخدام الهرمون (Disappearance rate أو Decay rate أو Disintegration rate أو Turnover rate) حيث أن معدل الاختفاء يساوي بالطبع معدل الإفراز، المعادلة (1).
6- يتم حساب نصف عمر الهرمون المشع (t1/2) باستخدام المعادلة (2).
تمتاز هذه الطريقة بسهولتها وسرعة إجرائها ولكن من عيوبها أنها تستخدم العناصر المشعة التي تتطلب أخذ الحيطة والحذر تجنباً للتعرض للإشعاع بالإضافة إلى ضرورة التخلص من الحيوان المستخدم في التجربة تجنباً للأضرار التي قد يسببها للإنسان.
(1) 
حيث Ln = اللوغاريتم الطبيعي Natural logarithm
K = معدل الاختفاء
 (2)
(2)
حيث T1/2 = نصف عمر الهرمون.
K = معدل اختفاء الهرمون من المعادلة (1).
Ln2 = اللوغاريتم الطبيعي للعدد 2 يساوي = 0.693.
2. طريقة استخدام الهرمون غير المشع
وتسمى أيضاً بطريقة الهرمون البارد أو الطريقة الكيميائية تختلف هذه الطريقة عن الأولى في أن الحيوان يتم حقنه بالهرمون غير المشع وتجميع عينات الدم لقياس تركيز هذا الهرمون في العينات على فترات مختلفة
باستخدام نظام التحليل المناعي الإشعاعي (RIA) أو ELISA ويمكن تلخيصها كالتالي:
1. يحقن الحيوان بتركيز محدد من الهرمون المراد معرفة معدل إفرازه.
2. يتم جمع عينات من الدم خلال فترات محددة بعد الحقن ولمد معينة (شكل 4).
3. يتم تحليل تركيز الهرمون داخل هذه العينات باستخدام نظام التحليل المناعي الإشعاعي كما سبق شرحه.
4. يتم حساب معدل الإفراز (وحدة وزنية /الزمن) وكذلك نصف عمر الهرمون (t1/2) من خلال حساب ما يلي:
معدل إفراز الغدة من الهرمون (وحدة وزنية / الزمن) = تركيز الهرمون قبل الحقن × حجم توزيعه في الجسم (لتر) × معدل اختفاءه (K)
يمكن الحصول على هذه المجاهيل كما يلي:
(أ) تركيز الهرمون قبل الحقن : بواسطة تحليل العينة باستخدام RIA.
(ب) حجم توزيع الهرمون داخل الجسم: من خلال حساب الكمية التي يتقاطع فيها المنحني مع الاحداثي السيني (شكل 4).
(جـ) معدل اختفاء الهرمون (K) باستخدام المعادلة التالية:

حيث K = معدل اختفاء الهرمون.
Ln = اللوغاريتم الطبيعي
مصف عمر الهرمون (t 1/2) = Ln2/K
حيث Ln2 هي اللوغاريتم الطبيعي للعدد 2 وتساوي 0.693
من عيوب هذه الطريقة أنها تحتاج إلى تثبيط الغدة وإيقاف وظيفتها قبيل إجراء التجربة ومن مزاياها أنها لا تستخدم النظائر المشعة مباشرة على الحيوان.
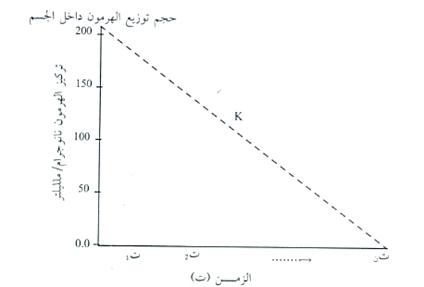
شكل4: معدل اختفاء الهرمون في الجسم
المصدر
القماطي ، احمد المجدوب (2005) . الغدد الصم وهرموناتها . كلية الزراعة . جامعة الفاتح .
 الاكثر قراءة في الغدد الصم و هرموناتها
الاكثر قراءة في الغدد الصم و هرموناتها
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


