

النبات

مواضيع عامة في علم النبات

الجذور - السيقان - الأوراق

النباتات الوعائية واللاوعائية

البذور (مغطاة البذور - عاريات البذور)

الطحالب

النباتات الطبية


الحيوان

مواضيع عامة في علم الحيوان

علم التشريح

التنوع الإحيائي

البايلوجيا الخلوية


الأحياء المجهرية

البكتيريا

الفطريات

الطفيليات

الفايروسات


علم الأمراض

الاورام

الامراض الوراثية

الامراض المناعية

الامراض المدارية

اضطرابات الدورة الدموية

مواضيع عامة في علم الامراض

الحشرات


التقانة الإحيائية

مواضيع عامة في التقانة الإحيائية


التقنية الحيوية المكروبية

التقنية الحيوية والميكروبات

الفعاليات الحيوية

وراثة الاحياء المجهرية

تصنيف الاحياء المجهرية

الاحياء المجهرية في الطبيعة

أيض الاجهاد

التقنية الحيوية والبيئة

التقنية الحيوية والطب

التقنية الحيوية والزراعة

التقنية الحيوية والصناعة

التقنية الحيوية والطاقة

البحار والطحالب الصغيرة

عزل البروتين

هندسة الجينات


التقنية الحياتية النانوية

مفاهيم التقنية الحيوية النانوية

التراكيب النانوية والمجاهر المستخدمة في رؤيتها

تصنيع وتخليق المواد النانوية

تطبيقات التقنية النانوية والحيوية النانوية

الرقائق والمتحسسات الحيوية

المصفوفات المجهرية وحاسوب الدنا

اللقاحات

البيئة والتلوث


علم الأجنة

اعضاء التكاثر وتشكل الاعراس

الاخصاب

التشطر

العصيبة وتشكل الجسيدات

تشكل اللواحق الجنينية

تكون المعيدة وظهور الطبقات الجنينية

مقدمة لعلم الاجنة


الأحياء الجزيئي

مواضيع عامة في الاحياء الجزيئي


علم وظائف الأعضاء


الغدد

مواضيع عامة في الغدد

الغدد الصم و هرموناتها

الجسم تحت السريري

الغدة النخامية

الغدة الكظرية

الغدة التناسلية

الغدة الدرقية والجار الدرقية

الغدة البنكرياسية

الغدة الصنوبرية

مواضيع عامة في علم وظائف الاعضاء

الخلية الحيوانية

الجهاز العصبي

أعضاء الحس

الجهاز العضلي

السوائل الجسمية

الجهاز الدوري والليمف

الجهاز التنفسي

الجهاز الهضمي

الجهاز البولي


المضادات الميكروبية

مواضيع عامة في المضادات الميكروبية

مضادات البكتيريا

مضادات الفطريات

مضادات الطفيليات

مضادات الفايروسات

علم الخلية

الوراثة

الأحياء العامة

المناعة

التحليلات المرضية

الكيمياء الحيوية

مواضيع متنوعة أخرى

الانزيمات
Plate count method APHA 2001 for heat resistant molds in foods
المؤلف:
SILVA, N.D .; TANIWAKI, M.H. ; JUNQUEIRA, V.C.A.; SILVEIRA, N.F.A. , NASCIMENTO , M.D.D. and GOMES ,R.A.R
المصدر:
MICROBIOLOGICAL EXAMINATION METHODS OF FOOD AND WATE A Laboratory Manual
الجزء والصفحة:
22-3-2016
3279
Plate count method APHA 2001 for heat resistant molds in foods
Method of the American Public Health Association (APHA), as described in 4th Edition of the Compendium of Methods for the Microbiological Examination of Foods (Beuchat and Pitt, 2001).
1 - Material required for analysis
• Sterile distilled water or equivalent
• 1.5 strength Potato Dextrose Agar (PDA) with antibiotics or 1.5 strength Malt Extract Agar (MEA) with antibiotics
• Water bath (closed) set to 75–80°C
• Laboratory incubator set to 30±1°C
2- Procedure
A general flowchart for the enumeration of heat-resist-ant molds in foods using the plate count method APHA 2001 is shown in Figure 1.
Attention: All the steps of the analysis of heat-resist-ant molds must be carried out in a laminar flow cabinet to avoid accidental contamination of the samples by molds from the environment.
a) Heat shock
a.1) For the analysis of fruits or pulps containing pieces of fruit(s), weigh 100 g of the sample in a sterile plastic bag, add 100 ml of sterile distilled water and homogenize in a stomacher for 2–4 min. After homogenization, transfer two portions of 50 ml to 200 × 30 mm tubes and place the tubes in a closed, temperature-controlled water bath set at a temperature between 75 and 80°C. Keep in the bath for 30 min, making sure that the surface of the product remains below the sur-face of the water in the bath.
a.2) For the analysis of non-concentrated fruit juices (Brix < 35°), transfer three 50 ml-portions of the sample to 200 × 30 mm tubes and use one of the tubes to adjust the pH to 3.4–3.6, with 10% NaOH (if the pH of the sample is higher than 3.4–3.6 the pH adjustment is not necessary). Record the volume of NaOH consumed to adjust the pH and aseptically add an equal amount of sterile 10% NaOH to the two other tubes. Discard the first tube and transfer the two other tubes to a closed, temperature-controlled water bath set at 75–80°C. Keep in the bath for 30 min, making sure that the surface of the product remains below the surface of the water in the bath.
a.3) For the analysis of concentrated fruit
juices (Brix > 35°), weigh 100 g of the sample in a sterile plastic bag, add 200 ml sterile distilled water and homogenize in a stomacher. After the homogenization, transfer three 50 ml-portions to 200 × 30 mm tubes, adjust the pH and proceed with the analysis in exactly the same way as described for non-concentrated juices. If the pH of the sample is higher than 3.4–3.6 the pH adjustment is not necessary.
b) Inoculation: Divide each 50 ml portions over four large Petri dishes (150 mm in diameter). Add to each plate 10 ml of 1.5 strength Potato Dextrose Agar (PDA) with antibiotics or 1.5 strength Malt Extract Agar (MEA) with antibiotics. Mix the sample well with the culture medium and wait until solidification is complete.
Note b.1) Pitt and Hocking (2009) describe the following alternative procedure: Weigh two portions of 50 g of the sample in stomacher bags or in 250 ml Erlenmeyer flasks. Samples with a Brix value greater than 35° should be diluted with 0.1% peptone water to a 1:1 ratio. Samples that are very acidic should have their pH adjusted to 3.5 to 4.0 with 10% NaOH. Subject the sample to heat shock in a hot water bath at 80°C/30 min. After heat shock, mix each 50 ml-portion of the sample with 50 ml of double strength Malt Extract Agar (MEA) with antibiotics or double strength Potato Dextrose Agar (PDA) with antibiotic, previously melted and cooled to 50–60°C. Homogenize well and distribute over five sterile, empty Petri plates and wait until solidification is complete. Incubate the plates at 30ºC for 30 days, examining visually every week.
c) Incubation: Transfer the plates to a sterile plastic bag, seal the bag well, to prevent the culture medium from drying out and incubate at 30ºC for up to 30 days, visually examining the plates every week. The majority of the viable spores will normally germinate and form visible colonies within 7–10 days. Heat-injured spores may require an
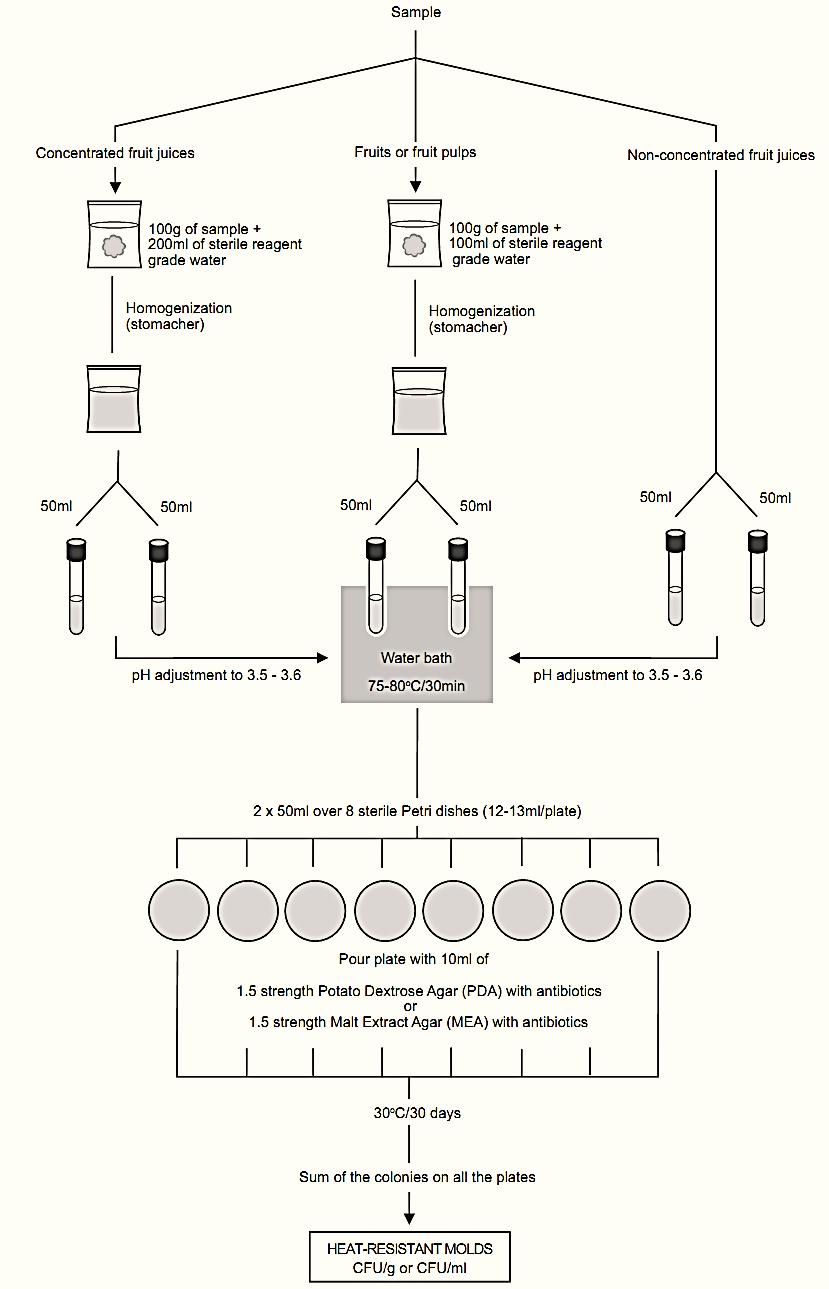
Figure 1 Scheme of analysis for enumeration of heat-resistant molds in foods using the plate count method APHA 2001 (Beuchat and Pitt, 2001).
additional period of time before they start to develop colonies.
d) Calculating the results: Count the colonies that developed on all the plates and calculate the result as number of spores/100 g or ml.
References
Silva, N.D .; Taniwaki, M.H. ; Junqueira, V.C.A.; Silveira, N.F.A. , Nasdcimento , M.D.D. and Gomes ,R.A.R .(2013) . Microbiological examination methods of food and water a laboratory Manual. Institute of Food Technology – ITAL, Campinas, SP, Brazil .
Beuchat, L.R. & Cousin, M.A. (2001) Yeasts and molds. In: Downes, F.P. & Ito, K. (eds). Compendium of Methods for the Microbio-logical Examination of Foods. 4th edition. Washington, American Public Health Association. Chapter 20, pp. 209–215.
Pitt, J.I. & Hocking, A.D. (eds) (2009) Fungi and Food Spoilage. 3rd edition. London, Springer.
 الاكثر قراءة في الفطريات
الاكثر قراءة في الفطريات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















