


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 25-1-2016
التاريخ: 19-5-2019
التاريخ: 19-3-2016
التاريخ: 21-5-2019
|
معایرة حمض قوى مع قاعدة قویة:
عند معایرة حمض قوي مع قاعدة قویة نجد أن المادة المحللة (المادة المراد تحلیلها) والمادة القیاسیة تتأین كاملاً كما في معایرة حمض الهیدروكلوریك ، وهیدروكسید الصودیوم حسب المعادلةالتالیة:
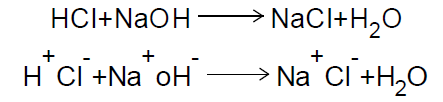
وتتحد أیونات (- OH) مع (+H) لتكوین جزئ ماء (H2O) أما الأیونات الأخرى
(Na+ & Cl-) فتبقى متأینة فى المحلول وتكون محصلة التعادل عبارة عن محلول (NaCl) المتعادل ، ومن منحنى معایرة 100 مل من HCl تركیزه N ( 0.1 ) مع NaOH ركیزه 0.1 N) ) نجد أن قیمة pH في بدایة المعایرة تساوي ( 1.0 ) و أثناء المعایرة نجد أن قیمة pH تزداد لأن تركیز أیون (H+) یقل نتیجة التعادل مع أیون (OH-) لیكون جزئي الماء وبذلك تزداد قیمة pH تدریجیاً بعد كل إضافة من NaOH على محلول الحمض إلى أن نصل إلى نقطة معینة یحدث فیها زیادة مفاجأة لقیمة pH من ( 4 -10 ) وهذه التغیر المفاجئ في قیمة ال pH یعبر عن قفزة المعایرة ، وهي المنطقة التي تحدد الدلیل المناسب الذي یستعمل في هذه المعایرة و في هذا النوع من المعایرات نجد أن دلیل ( الفینول نفثالین والمیثیل البرتقالي ) یصلحان كأدلة في هذه المعایرة ، ویتم رسم المنحنى برسم علاقة بین قیمة pH وحجم NaOH المضاف والشكل 34 یوضح منحنى معایرة حمض قوي HCl مع قاعدة قویة NaOH

ومن منحنى المعایرة نلاحظ الآتي:
تقع نقطة التكافؤ عند =pH7 لأن الملح الناتج NaCl محلوله متعادل
تتغیر قیمة pH ببطء شدید في بدایة المعایرة.
بالقرب من نقطة التعادل أو التكافؤ یحدث تغیر كبیر ومفاجئ من 4=pH إلى10=pH ویعرف هذا التغیر المفاجئ (بقفزة المعایرة) ،وهي تو افق العمودي من المنحنى وهذه القفزة لها أهمیة كبیرة إذ تقع في منتصف الخط العمودي



|
|
|
|
للعاملين في الليل.. حيلة صحية تجنبكم خطر هذا النوع من العمل
|
|
|
|
|
|
|
"ناسا" تحتفي برائد الفضاء السوفياتي يوري غاغارين
|
|
|
|
|
|
|
بمناسبة مرور 40 يومًا على رحيله الهيأة العليا لإحياء التراث تعقد ندوة ثقافية لاستذكار العلامة المحقق السيد محمد رضا الجلالي
|
|
|