

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الطرق الجهدية - الأجهزة والتطبيقات
المؤلف:
د.عبدالله محمود ابو الكباش
المصدر:
الكيمياء التحليلية المفاهيم الاساسية في التحليل التقليدي والالي
الجزء والصفحة:
ص 174-179
2024-02-10
2225
تُعد الطرق الجهدية من أقدم الطرق المتبعة في التحليل الكهروكيميائي، وتتميز هذه الطرق بسهولة إجرائها، وقلة تكاليف الأجهزة المستخدمة. كما أن الأقطاب المستخدمة لها عدة مميزات أهمها أن هذه الأقطاب لا تتأثر بلون المحلول ولا بكونه متعكراً، كما أن هذه الأقطاب لا تؤثر كيميائياً في المواد المراد تحليلها. وباختيار أنواع معينة يمكن تحليل العديد من الأيونات والمواد بسهولة. والطرق الجهدية تنقسم إلى قسمين هما :
1- طرق قياس الجهد المباشرة :
لسهولة هذه الطريقة فإنها تستخدم على نطاق واسع للمراقبة المستمرة لتراكيز العديد من المنتجات الصناعية أو الطبيعية. يعتمد هذا النوع من الطرق الجهدية على مقارنة جهد قطب الدليل بعد غمره في محلول العينة بجهد هذا القطب عند غمره في محلول قياسي للمادة المراد تحليلها. فعند غمر القطب الدليل والقطب المرجع في محلول قياسي A ، فإن فرق الجهد بين قطب الدليل والقطب المرجع يعبر عنه بالعلاقة التالية:
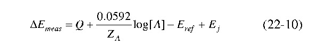
حيث Q ثابت تم تعريفه سابقاً ، ZA تعبر عن شحنة الأيون المراد تحليله Bret هي جهد القطب المرجع، عبارة عن الجهد الناتج من القنطرة الملحية وباستبدال[A]log بـ pA حيث :
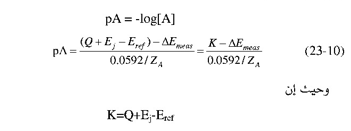
فعند غمر القطبين في المحلول القياسي المعروف التركيز وتعيين فرق الجهد  Emcas يمكن تعيين الثابت K. وعند غمر القطبين في محلول العينة وقياس فرق الجهد وبالتعويض عن K بالقيمة المعينة أعلاه يمكن تعيين تركيز أيون المادة المراد تحليلها.
Emcas يمكن تعيين الثابت K. وعند غمر القطبين في محلول العينة وقياس فرق الجهد وبالتعويض عن K بالقيمة المعينة أعلاه يمكن تعيين تركيز أيون المادة المراد تحليلها.
2- المعايرات الجهدية :
تعتمد هذه الطرق على اختيار قطب دليل مناسب للتفاعل الذي سيحدث في الخلية، ويوصل هذا القطب بجهاز مقياس الجهد. ثم يوصل القطب المرجع بالطرف الآخر لجهاز مقياس الجهد. ويستخدم المحرك المغناطيسي لتحريك المحلول بالخلية ويوضع المحلول المعاير في السحاحة وتبدأ عملية المعايرة بوضع محلول العينة في الخلية وإضافة كل المواد المطلوبة مثل المحلول الإلكتروليتي المساند ، ثم تتم إضافة أحجام معينة من السحاحة المحتوية على المحلول المعاير وبعد كل إضافة يقرأ الجهد. ويجب تقليل الحجم المضاف من السحاحة عندما يصبح التغير في الجهد كبيرًا إذ في هذه الحالة يفضل أن تكون الكمية المضافة على شكل نقط، ثم يتم رسم منحنى المعايرة برسم الجهد E كمحور صادي والحجم المضاف من السحاحة كمحور سيني. ومن هذا المنحنى يتم تعيين نقطة النهاية.
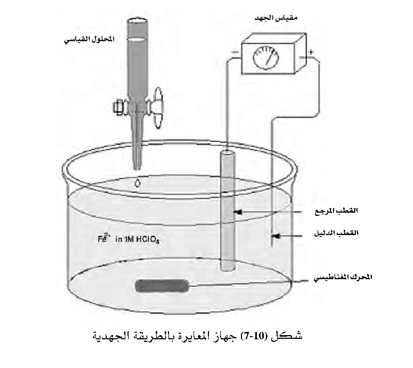

ويمكن تقسيم أنواع المعايرات الجهدية إلى نوعين رئيسين يستخدم كل نوع
قطب دليل مناسبا، وهذه الأنواع هي:
أ. معيارات الاندماج الأيوني وتشمل ما يلي:
معايرة الأحماض والقواعد، ويستخدم فيها عادة قطب الزجاج أو قطب الأنتيمون، وتسمى أيضاً معايرات pH ففي هذا النوع من المعايرة يتم تتبع التغير في تركيز أيون الهيدروجين [+H] ، [+pH= - log[H والتغير في درجة الحموضة pH يمكن تتبعه باستخدام قطب الهيدروجين الزجاجي مدمج معه القطب المرجع مثل قطب الكالوميل، حيث يمكن معايرة الأحماض القوية والضعيفة بمحلول قاعدي قياسي في المحاليل المائية، وكذلك يمكن معايرة القواعد بمحاليل أحماض قياسية ، حيث يمكن قياس الـ pH بعد كل إضافة من السحاحة ثم يتم رسم ا الـ pH كمحور صادي مع الحجم المضاف من السحاحة كمحور سيني ويرسم المنحنى.
ومن النقطة التي يغير فيها المنحنى اتجاهه، وتقع في منتصف الجزء الحاد نستطيع تعيين نقطة النهاية. ومن ثُمَّ تعيين تركيز المحلول المراد تحليله.
معايرات الترسيب في هذا النوع من المعايرات يستخدم القطب الدليل الذي يستجيب للتغير في تركيز الأيون مثل أيون الكالوريد -I- ، Br- ،Cl وكما مر معنا فإن الأقطاب المعدنية من النوع الثاني هي التي تستخدم في مثل هذا النوع من المعايرات مثل قطب الفضة الذي يستجيب لتركيز -I- ، Br- ،Cl
معايرة المعقدات وتشمل هذه معايرة المعقدات والكلابيات وتستخدم أقطاب البلاتين المملغمة كأقطاب دليلة.
ب . معايرات الأكسدة والاختزال
ويستخدم في هذا النوع من المعايرات أقطاب الذهب أو البلاتين، ويتم فيها استخدام القطب الدليل والقطب المرجع، ويتم قياس جهد قطب الدليل بالنسبة للقطب المرجع بعد كل إضافة من المحلول القياسي الموجود بالسحاحة. ثم يتم رسم الجهد المقاس كمحور صادي والحجم المضاف كمحور سيني. ومن نقطة تغير اتجاه منحنى المعايرة يتم تعيين نقطة النهاية، ومن الحجم عند هذه النقطة يمكن تعيين تركيز المحلول المراد تحليله من العلاقة VIC1 = V2C2
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















