

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
استخلاص وتنقية البروتينات Isolation and purification of proteins
المؤلف:
د. طارق يونس احمد / د. لؤي عبد علي الهلالي
المصدر:
الكيمياء الحياتية
الجزء والصفحة:
ج 1 ص401 -404
2023-11-30
4169
ان من المتطلبات الرئيسية في عمليات التنقية تحرير البروتينات من الخلية بدون تلف نشاطها بطرق تحطيم الخلايا (النباتية أو الحيوانية أو الأحياء (المجهرية والتي تستعمل طرق التجنيس Homogenization لتكسير جدران الخلايا وتحرير مكوناتها وطرق أخرى كما ذكر سابقاً الشكل (21 - 13)، وتحدد طريقة التجنيس بالاعتماد على نوع الخلية المراد فصل البروتينات منها، إذ كما هو معلوم بأن لكل طريقة ولها صفات معينة يمكن من خلالها تحديد نوعية الطريقة المناسبة لتكسير الخلايا وبعد الحصول على البروتين بشكل ذائب يمكن حينئذ عزل البروتينات الأخرى بالطرائق التي ذكرت سابقاً مثل : التجزئة بالتمليح الخارجي، الترس بالمذيب، بؤرة تعادل الشحنة كروماتوغرافيا الترشيح الهلامي Gel filtration كروموتوغرافيا التبادل الأيوني وغيرها.
يمكن الكشف عن نقاوة البروتينات بالطرائق الآتية:
1- قابلية الذوبان: لكل نوع من البروتينات قابلية ذوبان متميزة في مذيب معين، يمكن عن طريقها استخلاص البروتين المناسب.
2- الهجرة الكهربائي Electrophoresis.
3- طرائق الفصل الكروماتوغرافيا.
4- الكشف عن المكونات الموجودة في البروتينات مثل المعادن وغيرها.
5- الطرائق المناعية.
6- استعمال أجهزة النبذ المركزي الفائقة السرعة Ultracentrifuge.
وفيما يأتي شرح مبسط لعملية استخلاص وتنقية البروتينات:
1- عملية تحطيم الخلايا النباتية أو الحيوانية أو أحياء مجهرية). إذ هناك عدة طرائق، ويتم تحديـــد الطريقة استنادا الى نوعية الخلايا ومصدرها.
2- ترسيب البروتين
هناك عدة طرائق يتم من خلالها استخلاص البروتين وترسيبه من المحلول المتجانس وقد تم ذكرها فـــــي (الفصل السادس) وفيما يأتي بعض الملاحظات على عملية الترسيب:
هناك ثلاث طرق أساسية عادة تستخدم في عملية ترسيب البروتينات وهي:
أ- تغيير الأس الهيدروجيني
سبق توضيح ان ذوبان الإنزيم يكون أقل ما يمكن عند نقطة التعادل الكهربائي حيث لا توجد عند هذه النقطة قوى إلكتروستاتيكية بين جزيئات البروتين وبضبط الأس الهيدروجيني pH عند الدرجة المناسبة والمماثلة لنقطة التعادل يمكن ترسيب البروتين (أو الإنزيم).
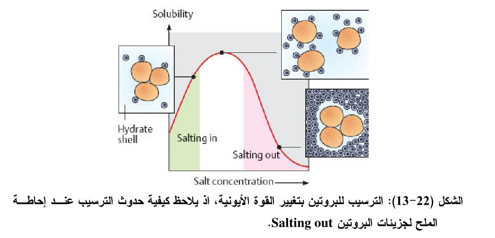
ب- تغيير القوة الأيونية
من المعروف إن الجزيئات ذات الشحنات الموجبة أو السالبة تكون عادة قليلة الذوبان في الماء النق اللاأيوني خالي من الايونات Deionized water وبالتالي فإن إضافة أيونات مماثلة لشحناتها ســــوف تساعد على الذوبان بالمساعدة على تفريق الشحنات على الجزيئات الكبيرة وتعرف هذه الظاهرة لإذابة الملح بالتمليح Salting in وإذا ما كانت القوة الأيونية تزيد عن نقطة معينة فإن الجزيئات التي تحمل شحنات سوف تترسب وتعرف بالإزاحة الملحية Salting out الشكل (22-13) وعلى الرغم من إن القاعدة النظرية لهذا السلوك غير مفهومة جيداً فإنه من المحتمل أن يكون العامل الرئيسي عند استخدام التركيز العالي من الملح يؤدي الى نقص واضح في تركيز الماء، وبالتالي يؤدي الى نقص حدوث الارتباط بين الذائب والمذيب وحينئذ يحدث الذوبان والملح المستخدم على نطاق واســــع فـــي تنقيـــة البروتينات هو كبريتات الأمونيوم ويرجع اختياره لعدة مميزات منها : رخص ثمنه وقدرته العاليــة علــــى الذوبان في الماء يحدث تشبع للمحلول باستخدام كبريتات الأمونيوم عند تركيز 528 غرام/لتر أو 4 مولار ولا يتغير هذا التركيز نسبياً عند درجات حرارية بين 5- الى 30 ο م ) ولانخفاض تأثيراته الضارة على معظم البروتينات (أو الإنزيمات) وكذلك انخفاض درجة حرارة مستخلص البروتين أثناء إذابته فيـــه. وكل بروتين معين عادة يترسب عند تركيز معين من كبريتات الأمونيوم وهذا هو الأساس في طريقــة التجزئة الابتدائية.
ج - خفض الثابت الكهربائي Dielectric constant
تؤدي إضافة المذيبات العضوية القابلة للذوبان في الماء (مثل الإيثانول والاسيتون) الى خفض الثابت الكهربائي (Dielectric constant) للمحلول وبالتالي زيادة القوى الإلكتروستاتيكية. أن إضافة بعض أنواع المذيبات العضوية قد يؤدي في بعض الأحوال الى فقد الإنزيمات لنشاطها (نتيجة للمسخ)، ومــن المهم في تطبيق هذه الطريقة اختيار المذيب المناسب وأن تتم في درجات حرارة منخفضة للتقليل مــن عملية المسخ. وهناك عدة اعتبارات عند تطبيق هذه الطريقة منها:
- لا تقل درجة نقاوة المذيب المستخدم عن 99%.
- يجب إتمام هذه الطريقة في درجة حرارة منخفضة ويفضل أن تكون - 0-4 Ο م.
- يفضل استخدام المذيب بنسبة يسمح بترسيب البروتين والمحافظة على نشاطه.
3- فصل البروتين بالاعتماد على حجمه الجزيئي بعد عملية الترسيب للبروتين ومن طرق الفصل هذه :
أ- الفرز الغشائي Dialysis( والتي تم التطرق أليها سابقاً).
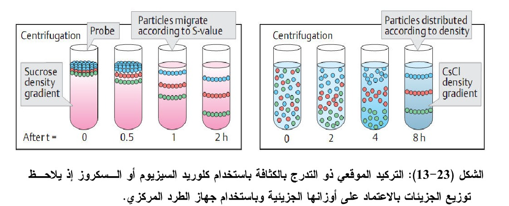
ب- التركيد الموقعي ذو التدرج بالكثافة باستخدام جهاز الطرد المركزي (النبذ) Zonal density gradient centrifugation
يمكن فصل خليط بروتيني بطريقة النبذ وبالأخص ذي التدرج الكثافي الموقعي. وتتم العملية كمـا فـــي الشكل ( 23-13)، وذلك بوضع تدرج كثافي من كلوريد السيزيوم CsCI أو تدرج كثافي من السكروز في أنبوبة بلاستيكية يخلط فيها محلول السكروز المركز (أو) كلوريد (السيزيوم مع الماء بنسب تنازلية الى أعلـى الأنبوبة وإجراء الفصل باستخدام جهاز الطرد المركزي.
ج- كروماتوغرافيا الترشيح الهلامي Chromatography gel filtration) والتي تم التطرق لها سابقا).
4- طرق الفصل للبروتينات بالاعتماد على الشحنة الكهربائية
تعود طرائق فصل البروتينات التي تعتمد على الشحنة الكهربائية الى صفاتها القاعدية والحامضية لوجود عدد من المجاميع الأيونية في السلاسل الببتيدية. وهناك عدة طرائق للفصل بالاعتماد على الشحنة منها:
أ- كروماتوغرافيا التبادل الأيوني.
ب- الهجرة الكهربائية Electrophoresis وباستخدام عدة تقنيات منها).
5- فصل البروتينات بالإمتزاز الاختياري Selective adsorption يمكن إمتزاز البروتينات عند إمرارها على أعمدة فصل تحوي الطور الصلب على مواد خاملة مواد غير قطبية مثل الفحم وكذلك المواد القطبية مثل هلام السليكا Silica gel ويعتقد ان قوى فاندرفال والتداخلات الهيدروفوبية Hydrophobic هي المسؤولة عن إمتزاز البروتينات مع المواد غير القطبيــة. اما المواد القطبية فتتأثر بعوامل أخرى حيث إمتزازها للبروتين يعتمد على الانجذاب الأيوني والآصرة الهيدروجينية. ويعد الهيدروكسي ابيتايت Hydroxy appetite من أكثر المواد استخداماً لتنقية البروتينات عن طريق ارتباط الشحنة السالبة الموجودة في البروتينات مع الكالسيوم الذي يشكل جزءاً من هذه المواد.
6- فصل البروتينات بالاعتماد على كروماتوغرافيا الألفة Affinity chromatography.
 الاكثر قراءة في الاحماض الامينية والبروتينات
الاكثر قراءة في الاحماض الامينية والبروتينات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















