
مكافئ المادة المؤكسدة أو المختزلة Equivalent Weight of Oxidizing and Reducing Agents
 المؤلف:
أ. د محمد مجدي واصل
المؤلف:
أ. د محمد مجدي واصل
 المصدر:
اسس الكيمياء التحليلية
المصدر:
اسس الكيمياء التحليلية
 الجزء والصفحة:
ص 222 - 230
الجزء والصفحة:
ص 222 - 230
 2023-09-19
2023-09-19
 6838
6838
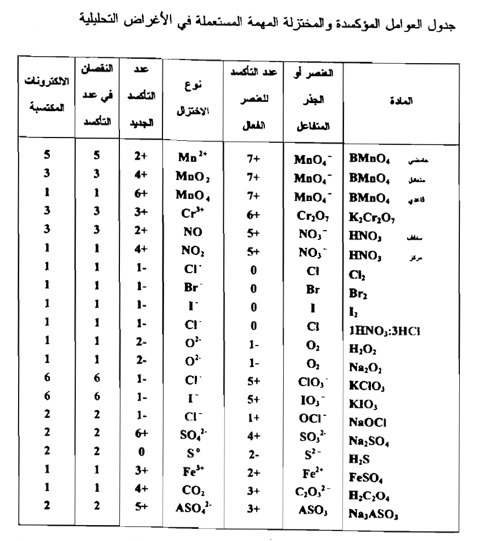
إن مكافئ المادة المؤكسدة أو المختزلة هو المول مقسوم علي عدد الالكترونات التي يكتسبها أو يفقدها مول واحد في التفاعل مثلاً
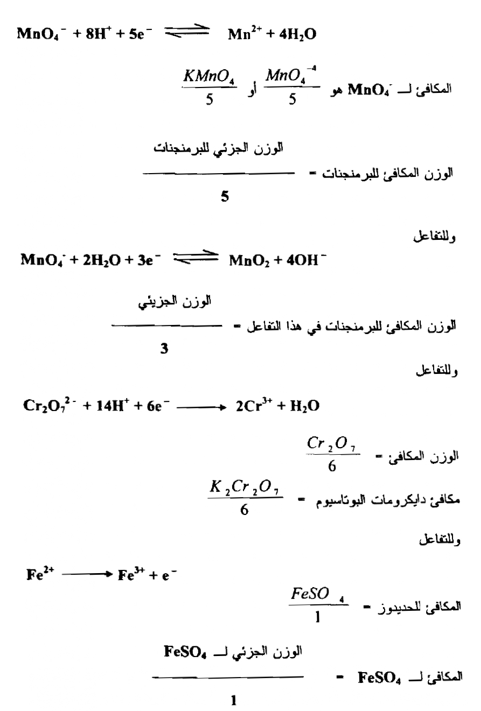
وتعتمد الطريقة الأخرى لحساب الوزن المكافئ لمادة مؤكسدة أو مادة علــى معرفة التغير في عدد التأكسد Oxidation Number أو حالة التأكسد أو التكافؤ . أن عدد التأكسد هو عدد يدل على مقدار التأكسد أو الاختزال المطلوب لتحويل ذرة واحدة من ذلك العنصر من الحالة الحرة Free state إلى الحالة التي توجد في ذلك المركب . فإذا كان التأكسد ضرورياً لإحداث التغير يكون عند التأكسد موجباً وإذا كان الاختزال هو الضروري يكون عدد التأكسد سالباً .
وتنطبق القواعد التالية لإيجاد أعداد التأكسد :
1- يكون عدد التأكسد للعناصر في حالتها الحرة أي غير المتحدة ، صفراً .
2- يكون عدد التأكسد للأوكسجين ( عدا قسم من الهيدريدات ) مساوياً إلى +1
3- يكون عدد التأكسد للأوكسجين ( عداه في البيروكسيداتية ) مساوياً إلى -2
4- يكون عدد التأكسد للفلز المتحد ( عدا الهيدريدات ) عادة موجباً .
5- يكون عدد التأكسد للجذر أو الأيون مساوياً إلى شحنته الكهربائية
6- عدد التأكسد للمركبات دائماً صفر ويعين بجمع أعداد التأكسد للذرات المنفردة مضروب كل منها بعدد ذرات العنصر في جزيئة ذلك المركب
يعين مكافئ مادة مؤكسدة بالتغير الذي يحدث في عدد التأكسد الذي يعانيه العنصر المختزل وهي كمية المؤكسد التي تدخل في تغير واحد في عدد التأكسد فمثلاً في الاختزال الاعتيادي لبرمنجنات البوتاسيوم بوجود حامض الكبريتيك المخفف إلى ملح المنجنيز الثنائي :
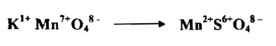
التغير في عدد التأكسد للمنجنيز هو من 7 إلى 2 وعليه فإن مكافئ برمنجنات البوتاسيوم يكون 1/5 مول منه وبصورة مماثلة فإن اختزال دايكرومات البوتاسيوم في محلول حامضي

إن التغير في عدد التأكسد لذرتين من الكروميوم هو من +12 إلى 6+ وإن مقدار التغير هو 6 وحدات اختزالية وعليه فإن مكافئ دايكرومات البوتاسيوم هو 1/6 مول ولإيجاد مكافئ مادة مؤكسدة نقسم كتل المواد علي عدد التغير في عدد التأكسد بالمول الذي يعانيه عدد من العناصر في المادة وبالطريقة نفسها يعين الوزن المكافئ لمادة مختزلة بالتغير في عدد التأكسد الذي يعانيه العنصر المتأكسد في تلك المادة . فلاستخراج مكافئ الحديد الثنائي في كبريتات الحديدوز الذي يتأكسد إلي كبريتات الحديديك
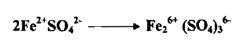
إذ التغير في عدد التأكسد بمول من الحديد هو من +2 إلى +3 أو بوحدة واحدة ، وعليه فإن مكافئ الحديد الثنائي في كبريتات الحديدوز هو مول واحد . ولنأخذ التفاعل المهم الآخر وهو تأكسد حامض الأكساليك إلي ثاني أكسيد الكربون والماء .

فإن التغير في عدد التأكسد لذرتين من الكربون هو من 6 إلي +8 أي بوحدتين من وحدات التأكسد ولذلك فإن مكافئ حامض الأكساليك هو 1/2 مول . وعلى العموم يمكن أن يقال :
1- إن مكافئ عنصر يشترك في تفاعل تأكسدي - اختزالي هــ كتلته الذرية مقسومة على التغير في عدده التأكسدي .
2- عندما تعاني ذرة في جزيئة معقدة تغيراً في عدد التأكسد ( عملية تأكسد أو اختزال ) فإن مكافئ المادة هو المول مقسم على التغير في عدد التأكسد للعنصر المؤكسد أو المختزل . فإذا وجد أكثر من ذرة للعنصر المتفاعل فإن عدد التأكسد المول يقسم علي التغير الكلي في عدد التأكسد .
إننا الآن في موقف يمكننا أن نفهم بوضوح أكثر سبب تغير مكافئات عدد من المواد بتغير التفاعلات سنأخذ مثالين مألوفين لغرض التوضيح . إن المحلول الاعتيادي لكبريتات الحديدوز الثنائي H2O7 . FeSO4 له مكافئ 1 مول عندما يستعمل لمختزل أما مكافئه عند استعماله كمرسب مع محلول الأمونيا فهو ½ مول .
مثال :
كم جراماً من المواد المؤكسدة الآتية يعادل الوزن المليمكافئ الجرامي لكل منها
أ K3Fe(CN)6 -
ب KMnO4– بوجود حامض وبوجود قاعدة .
جــ - 7 K2Cr2O
د- KbrO3
الحــــــل :
K3Fe(CN)6 -1 يعطي هذا الملح في المحلول المائي أيونات الفيريسيانيد التي تختزل إلى أيونات ( الفيروسيانيد(
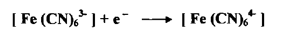
وعليه فالتغير في العدد التأكسدي للحديد هو من 3+ إلي 2+
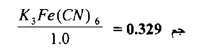
ب KMnO بوجود حامض يختزل إلى أيونات المنجنيز

فالتغير في العدد التأكسدي للمنجنيز هو من +7 إلى 2+
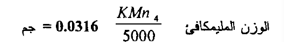
وتختزل البرمنجنات في المحلول القاعدي إلى MnO2 يتغير في عدد التأكسد مقداره من +7 إلي 4+

وعليه فالوزن المكافئ هو ½ الوزن الجزيئي
جـ - 7 K2Cr2O
تختزل أيونات الدايكرومات اعتياديا إلى أيونات الكروميك

د- KbrO3
تختزل البرومات إلي البروميد فيتغير العدد التأكسدي للبروم من +5 إلي -1 أو أن مقدار التغير هو 6
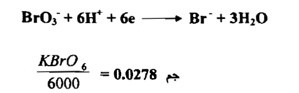
ولما كان تركيز المحاليل في التسحيحات التأكسدية - الاخترالية مماثلاً لتلك التي في التسحيحات الحامضية القاعدية ومبيناً على أساس مكافئ الهيدروجين فإن الطرق العامة للحسابات تكون متماثلة وهكذا فإن محلولاً عيارياً واحداً من العامل المؤكسد سيؤكد بالضبط ليتراً واحداً من محلول عياري لمادة مختزلة أو ليترين من محلول نصف عياري وعليه تطبق نفس الصيغة الحسابية الآتية :

 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


