علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
العوامل المؤكسدة المهمة
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص214-218
2023-09-19
4286
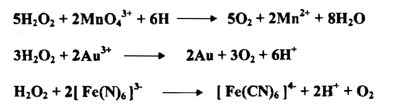
1- برمنجنات البوتاسيوم :
وهي مادة في حالتها الصلبة تعطي محلولاً مائياً بنفسجياً يميز هذه المادة وهذه المادة مؤكسدة قوي تعمل على وفق الـ pH الوسط التفاعلي
أ - في الوسط الحامضي تختزل بواسطة 5 الكترونات .
إذ يتغير عدد التأكسد للمنجنيز من +7 إلى +2 كما هو مبين في المعادلة السابقة إن بعض التفاعلات المهمة التي تنجز بواسطة أيونات البرمنجنات في محيط حامضي هي :
ب – في محلول وسط متعادل أو قاعدي ضعيف تختزل البرمنجنات الي ثاني أكسيد الكربون إذ يتغير عدد التأكسد للمنجنيز من +7 إلى +4
وكمثال على ذلك أيضاً تأكسد المنجنيز الثنائي .
ونظراً لتكوين أيون الـ H فقد ينعكس التفاعل لذا يجب استعمال محلول منظم Buffer solution يستعمل هذا التفاعل في معايرة المنجنيز وتعيينه كمياً إذ يستعمل أكسيد الزنك ZnO بوصفه منظماً .
ج - في محلول قاعدي قوي ( 13 = pH أو أكثر ) تختزل البرمنجنات الي أيون البرمنجنات بفقدان إلكترون واحد كما يأتي:

إذ يكون عدد التأكسد للمنجنيز+ 6 وتظهر البرمنجنات لوناً أخضر مميزاً . فعندما تسخن البرمنجنات مع القلويات يحدث التفاعل الاختزالي ويتطلق الأوكسجين .

2- دايكرومات البوتاسيوم : K2Cr2O7
وتعد هذه المادة مؤكسداً قوياً وهي مادة حمراء برتقالية في حالتها الصلبة تنتج محلولاً مائياً برتقالياً . تختزل أيونات الدايكرومات في المحلول الحامضي القلوي إلى الكروميوم الثلاثي كما في المعادلة الآتية :

3- حامض النتريك :
يعتمد التأثير التأكسدي لحامض النتريك على قوة تركيزه ودرجة حرارة المحلول وعادة يتكون أكسيد النتروجين في عملية اكتساب ثلاثة إلكترونات .

إن غاز NO عديم اللون ولكنه يتفاعل مباشرة مع أوكسجين الهواء فيتكون غاز ثاني أكسيد النتروجين
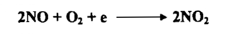
ويمكن سكب حامض النتريك ( مزيج 1 : 1 حامض النتريك المركز والماء ) علـى برادة حديد مع تسخين الخليط ، فنستطيع أن نرى الحديد يعطي غاز عديم اللون .
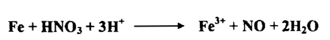
يستعمل حامض النتريك المركز أو نصف المركز غالباً لإذابة الفلزات والراسب حسب التفاعلات الآتية :
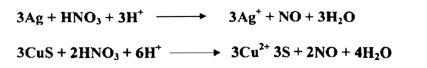
ونظراً لأن حامض النتريك تحت الظروف التي تجري فيها هذه التفاعلات لا يكون متفككاً كلياً نستعمل الصيغة HNO3 في المعادلات المذكورة آنفاً
4- الهالوجينات :2 I2 , Br2, Cl
يعتمد فعل الهالوجينات على تحول جزيئاتها المتعادلة بطريقة كهربائية الي أيوناتها بتقبلها للإلكترونات

تقل القدرة التأكسدية للهالوجينات بزيادة الكتلة الذرية النسبية لها فاليود مؤكسد معتدل في حين يعمل أيون اليود غالباً بوصفه مختزلاً . وفيما يأتي عدداً من التفاعلات التـي تستعمل في التحليل نذكر
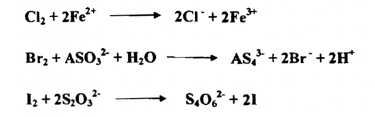
5- الماء الملكي : Aqua Regia
إن الماء الملكي مزيج من ثلاثة حجوم من حامض الهيدروكلوريك المركز وحجم واحد من حامض النتريك المركز وهو عامل مؤكسد قوي ، قادر على أكسدة الفلزات النبيلة وإذابتها Noble Metals كالذهب والبلاتين . وتأثيره علي أساس تكوين الكلور كما في المعادلة المبسطة الآتية :
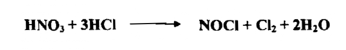
وفي الحقيقة تتكون نواتج أكثر في إثناء العملية فمثلاً يكون كلوريد النترزيل ويمكن الكشف عنه بسهولة ، يمكن التعبير عن انحلال الذهب بالمعادلة الآتية :

6- فوق أكسيد الهيدروجين :
يعمل فوق أكسيد الهيدروجين بوصفه عاملاً مكسداً وعاملاً مختزلاً فعمله التأكسدي يقوم على أساس اكتساب إلكترونين في محيط حامضي كما توضحه المعادلة الآتية:

إن عمل فوق أكسيد الهيدروجين التأكسدي - الاختزالي يعتمد نسبياً علي القوة التأكسدية النسبية أو القوة الاختزالية النسبية للمواد التي تتفاعل معه وعلي الأس الهيدروجيني pH للمحلول مثلاً مع فوق أكسيد الهيدروجين في محيط حامضي
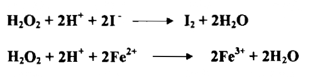
وهو يستطيع أن مؤكسداً في وسط قاعدي أيضاً فمثلاً المحلول القاعدي المحتوي على كروميوم ثلاثي يمكن أن يتأكسد بواسطة فوق أكسيد الهيدروجين إلى الكروم الرباعي

كذلك يمكن انجاز الاخنزال بواسطة فوق اوكسيد الهيدروجين في محيط حامضي او محيط قاعدي .
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)