1 - طرق التحليل الحجمي بالتعادل Neutralization Methods :
المقصود بالتعادل تكوين ملح وماء في نهاية التفاعل . وتشمل هذه الطريقة التحليلات الحجمية كافة المعتمدة علي أساس تعادل القواعد المنفردة أو الناتجـة مـن التحليل المائي للأملاح المتكونة من تفاعلات أحماض ضعيفة قواعد قوية . مع أحماض قياسية وهو ما نسميه بالطريقة الحامضية Acidimetry ، وكذلك تشمل معادلة الأحماض المنفردة أو المتكونة من التحلل المائي للأملاح الناتجة من تفاعل قواعد ضعيفة وأحماض قوية مع قواعد قياسية وهو ما يسمي بالطريقة القلوية Alkalimetry وهكذا فإن هذه التفاعلات في الأصل تعني إتحاد أيونات الهيدروجين بأيونات الهيدروكسيل وهو ما يعبر عنه أو ينطبق عليه التفاعل العام :
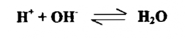
وفي حالة التعادل وعند نقطة انتهاء التفاعل التي يظهرها الدليل يكون pH المحلول مساويا 7 . أما في غير هذه الحالة فإن زيادة تركيز OH- في المحلول تعني أن pH المحلول > 7 في حين زيادة تركيز+ H في المحلول تعني أن pH المحلول < 7 . إن قيمة pH المحلول عند نقطة انتهاء التفاعل تعتمد من حيث الأساس على طبيعة وتركيز محاليل المواد المتفاعلة . فحين يسمح محلول حامضي قوي مع محلول قاعدة قوية كما في التفاعل الآتي :

2- طرق التحليل الحجمي بالترسيب : Precipitation Reaction Methods
هي تفاعلات يعتمد انتهاء التفاعل فيها على إتمام ترسيب المادة . وفي أغلب الأحيان يكون الراسب المتكون بسيطاً يعتمد على أنواعه علي الأيونات المتفاعلة التـ هي ليست أيونات الهيدروجين وأيونات الهيدروكسيل مثل ما يحدث عند معايرة نترات الفضة مع كلوريد الصوديوم .
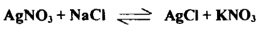
وقد يتفاعل الراسب بعد تكوينه مع المادة المرسبة مكوناً أيونات معقدة كما يحدث عندما يترسب سيانيد الفضة الأبيض اللون من معايرة نترات الفضة مع سيانيد البوتاسيوم . إذ يذوب سيانيد الفضة في وفر من سيانيد البوتاسيوم مكوناً سيانيد الفضة البوتاسيومي .
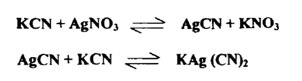
وفي جميع هذه التفاعلات لا تعاني الأيونات المتحدة لتكوين الرواسب من أي تغيير في تكافؤاتها . ولأن نترات الفضة تستعمل مرسباً في أهم عمليات الترسيب في التحليل الحجمي، لذلك سميت هذه باسم عمليات التحليل الفضي Argentimetric processes ومن أمثلة هذه العمليات تقدير الهاليدات بترسيبها علي صورة هاليدات الفضة ، وذلك بمعايرة محاليل قياسية لنترات الفضة مع محاليل الهاليدات المعينة بوجود الدليل المناسب .
ويمكن أن تتم هذه التقديرات بطريقتين :
أ- الطرق المباشرة : Direct methods
وهي عمليات المعايرة التي يتم بموجبها إضافة محلول نترات الفضة - المعاير titrant إلى المحلول المجهول لحين الوصول إلى نقطة إنهاء التفاعل . وتشمل الطرق المعروفة الآتية :
1- طريقة موهر : Mohr's method
ويكثر استعمالها لمعايرة أيوني الكلوريد والبروميد بمحلول قياسي من نترات الفضة واستعمال كرومات البوتاسيوم كدليل . ويستند في استعمال هذا الدليل لتعيين نقطة انتهاء التفاعل علىتكوين راسب آخر ذي لون يتميز من لون الراسب الأصلي . كما يجب أن يراعي في استعمال الدليل حموضة الوسط الذي يتم فيه التفاعل ويفضل أن تكون قيمة pH المحلول بين 7 - 10
2 - طريقة فاجان : Fajan's method
وهي طريقة معايرة مباشرة تعتمد علي إضافة دلائل الامتزاز Adsorption Indicators ، تعطي لوناً مميزاً لسطح الراسب ، ويشير اختفاء لونه أو ظهوره إلي نقطة انتهاء التفاعل . ومن الدلائل المستعملة في طريقة فاجان ، الصبغة العضوية المعروفة باسم الفلورسین flaorescein
ب الطرق غير المباشرة : Indirect methods
وهي الطرق التي تعتمد علي تكوين المعقدات الملونة وتشمل طريقة واحدة هي طريقة فولهارد Volhard's method التي يستعمل فيها محلول ثايوسيانات البوتاسيوم، أو الأمونيوم القياسي في معايرة أيون الفضة باستعمال ملح حديديك في وسط حامضي قوي منها لتحلل مركبات الحديديك المستعملة بوصفها دليلاً في عمليـ المعايرة هذه ؛ لأنه يكون لوناً أحمر مع أي من الثابوسيانات

وتستعمل نفس المحاليل القياسية من نترات الفضة والثايوسيانات في تقدير البروميد واليوديد والسيانيد والفضة .
وتتم الطريقة غير المباشرة هذه لتعيين الهاليدات بإضافة زيادة عن الحجم المطلوب من محلول نترات الفضة القياسي ومن ثم تستخدم ) المعايرة العكسية Back titration ) مع محلول الثايوسيانات القياسي لتعيين كمية الزيادة من محلول نترات الفضة المضافة .
3- طرق التحليل الحجمي بتكوين المعقدات : Complex methods based on complex formation Reaction
يستفاد من الأيونات أو الجزيئات المحتوية علي زوج واحد من الالكترونات المنفردة الأيونات . تجزيئات الماء والأمونيا وأيونات الكلوريد القابلة لتكون رابطة بين الجزيئات أو الأيونات والأيونات الفلزية المستقبلة لهذه الالكترونات مكونة معقدات تناسقية . تكون فيها نسب الأيونات المترابطة متفاوتة اعتماداً علي الارتباط التناسقي الذي تحكمه الأعداد الثابتة من الروابط التناسقية . واستناداً لهذه النسب يمكن تقدير عدد كبير من أيونات الفلزات بمعايرتها مع كاشف تعاضدي لتكوين معقدات تعضدية أو مخلبية Chelates قابلة للذوبان في الماء وتنشأ من تفاعلات أيونات الفلزات والكاشف الذي قد يحتوي علي مجموعتين واهبتين أو أكثر فيسمي ثنـ الترابط bidenate أو ثلاثي الترابط tridenate ومن الكواشف الشائعة الاستعمال في التحليل الكمي لتكوين المعقدات المخلبية التي أحدثت تطوراً سريعاً إضافة إلي دقة النتائج العملية ما يأتي:
أ- الإيثلين ثنائي الأمين رباعي حامض الخليك الذي يرمز له EDTA
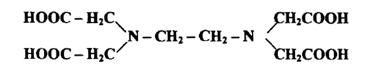
ب- نتريلو ثلاثي حامض الخليك Nitrilotriacetic acid ويرمز له بـ NTA أو NITA
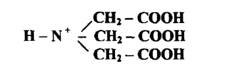
4- طرق التحليل الحجمي بقياس الأكسدة والاختزال : Oxidimetry and Reductimeetry:
إن التفاعلات في هذا التحليل تختلف عن غيرها بكونها دوماً مصحوبة بتغير في التكافؤ أي : بانتقال الالكترونات إذ تكون المواد المتفاعلة مانحة للالكترونات فتسمي بالعامل المختزل Reducing Agent - تفقد الكتروناتها - أو المكتسبة للالكترونات فتسمى بالعامل المؤكسد Oxidizing Agent وبناء علي ذلك فيجب أن يتضمن كل من تفاعلات التأكسد - الاختزال نصفي تفاعل Half Reaction أحدهما تفقد فيه الالكترونات من المادة ، وهو ما يسمي بعملية التأكسد ، والتفاعل النصفي الثاني هـو الذي تكتسب فيه المادة الالكترونات وهو ما يسمي بعملية الاختزال . كما أن نسبة الأوزان الجزيئية للمادة المؤكسدة في التفاعل إلى الأوزان الجزيئية للمادة المختزلة فيه هي كنسبة عدد الالكترونات المكتسبة إلى عدد الالكترونات المفقودة لهذه المواد ويمكن أن يمثل لذلك باختزال كلوريد الحديديك بواسطة كلوريد القصديروز بما يأتي :
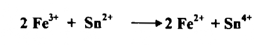
فنجد أن أيون الحديديك قد اكتسب الكترونات ولذا تم اختزاله . أما أيون القصديروز فقد إلكترونين ، وبذلك تمت أكسدته إلى أيون القصديريك . وبمراعاة النسب فإنه يلزمنا أيونان من أيونات الحديديك لأكسدة أيون واحد من أيونات القصديروز
ومع أن تفاعل العوامل المؤكسدة القوية والعوامل المختزلة القوية تفاعلات تامة وصالحة للتحليل الحجمي فإن قسماً من تفاعلات التأكسد - الاختزال لا تصلح للتحليل الحجمي بإعتبارها تفاعلات عكسية غير تامة وهو ما يحدث عند تفاعل عامل مؤكسد ضعيف مع عامل مختزل ضعيف .
وتشمل أهم هذه التفاعلات ما يأتي :
1- تفاعلات برمنجنات البوتاسيوم :
يستعمل محلولها في التحليل الحجمي بوصفه عاملاً مؤكسداً الا أن نسبة الأوكسجين الفعال الذي ينطلق منها يعتمد على الوسط الذي يتم فيه التفاعل ففي كما يلي :
أ- الوسط الحامضي :
تتفاعل البرمنجنات مع العامل المختزل بوجود الحامض المخفف على حسب ما يعبر عنه نصف التفاعل بما يأتي:
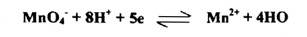
ويظهر في هذا التفاعل عدد تأكسد المنجنيز في أثناء التفاعل بأن الوزن المكافئ للبرمنجنات يساوي 1 / 5 صيغتها الجزيئية وهذه هي أكثر الحالات استخداماً فــــي التحليل الحجمي .
ب- في الوسط القاعدي الضعيف :-
مثل كاربونات الصوديوم يمكن التعبير عن التفاعل بما يأتي :

والوزن المكافئ الجرامي هنا يساوي 3/1 الوزن الجزيئي الجرامي .
إن برمنجنات البوتاسيوم وتتميز بكون محلولها عاملاً مؤكسداً قوياً غير أنهـا ليست جيدة بوصفها مادة أولية للتحليل إذ يصعب تجهيزها نقية خالية من MnO ، وتتأثر بالشوائب العضوية وغيرها مما يتصل بها من الماء أو الآتية بسبب قوة أكسدتها فتختزل إلي MnO2 الذي ينشط بدوره للعمل بوصفه وسيطاً لانحلال البرمنجنات في المحلول انحلالا ذاتياً ، ولذلك وجب مراعاة النظافة القصوي في الآنية المستخدمة لحفظ المحاليل القياسية . ولا يتطلب استخدامها في المعايرة استعمال أي دليل للاهتداء إلي نقطة انتهاء التفاعل إذ يختفي لون محلول البرمنجنات عند زيادته تدريجياً من السحاحة على محلول العامل المختزل في الوسط ودرجة الحرارة المناسبين
2 - تفاعلات ثنائي كرومات البوتاسيوم : K2Cr2O7
تعتبر ثنائي كرومات البوتاسيوم من العوامل المؤكسدة القوية التي تتميز عن برمنجنات البوتاسيوم في التحليل الحجمي بأنه من الممكن تجهيزها بدرجة عالية من النقاوة ومحاليلها ثابتة لا تتأثر بالشوائب العضوية المختزلة فهي مادة جيدة أوليـــة للتحليل . كما أن محلولها لا يتأثر بحامض الهيدروكلوريك مادام المخلوط بارداً لا يتعدى قوة الحامض 2 عياري وعندها تكون محاليل هذه المادة أفضل لتقدير الحديد في معاونة بإذابة عينات من هذه المعادن في HCI ويختزل الحديديك فيها إلي حديدوز بواسطة كلوريد القصديروز.
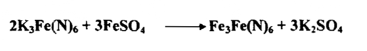
ويتم الكشف عن نقطة انتهاء التفاعل باستعمال ثنائي كرومات البوتاسيوم عنــد إضافته محلول العامل المختزل في وسط حامضي الكبريتيك والهيدروكلوريك . تتميز الكرومات بزوال لونها البرتقالي وتجمع لون كبريتات أو كلوريد الكروميـك المائل للخضرة في الخليط . وبمجرد تخطي نقطة انتهاء التفاعل يصبح اللون الناتج خليطاً من هذين اللونين . وفي مثل هذا التحول يصعب إيجاد نقطة انتهاء التفاعل بلا استخدام الدليل المناسب للاهتداء إليها بأحدى الطريقتين :
أ- استخدام مركبات عضوية عطرية ( أروماتية ) بوصفها دلائل داخلية مثل ثنائي فنیل آمین Diphenylamine أو فنيل أنيلين Phenyl aniline إذ نحصل علي لون ارجواني أو بنفسجي قاتم مائل للزرقة ثابت عند الرج .
ب- استخدام محلول سيانيد البوتاسيوم الحديديكي 6(N)K3Feبوصفه دليلاً خارجياً يتفاعل مع محلول الحديد الحديدوزي إذ يتكون راسب أزرق من حديدي سيانيد الحديدوز
3- التفاعلات المشتملة على اليود : Iodomitry
تعرف عملية تقدير العوامل المختزلة القوية والضعيفة عند معايرتها مع محلول قياسي لليود باسم القياس اليودي أو القياس باليود Iodimetry- أما تقدير العوامل المؤكسدة فيتضمن إضافة مقدار كاف من يوديد البوتاسيوم أو الصوديوم علي مقدار معين من محلول العامل المؤكسد فتزيد كمية اليوديد المضافة عما يلزم لتمام اختزال العامل المؤكسد كما في المعادلة :
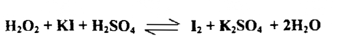
ويقاس اليود المنفصل مذاباً في الزائد من اليوديد بمحول قياسي لعامل مختزل مناسب من بين العوامل المختزلة كثايو كبريتات الصوديوم Na2S2O3.5H2O . ومن العوامل المؤكسدة التي يجري تقديرها بهذه الطريقة :
1 - كبريتات النحاسيك 4CuSO
2- كلورات البوتاسيوم KCIO3
3- ثنائي كرومات البوتاسيوم K2Or2O7
4- برمنكانات البوتاسيوم 4KMnO
أما المواد المختزلة فمن أمثلتها :
1- أوكزالات الصوديوم Na2C2O4
2- حامض الأوكزاليكO 2H2 . 2( COOH )
3 -كبريتات الحديدوز FeSO4
4- كبريتات الأمونيوم 6H2O . NH4 )2SO4 )
5- ثيو كبريتات الصوديوم Na2S2O3.5H2O
6- مركبات القصديروز+2 Sn .
ويستعمل محلول النشاء الذائب Soluble starch بوصفه دليلاً داخلياً عن نقطة انتهاء التفاعل عند معايرة محلول اليود بمحلول مختزل ويضاف إليه من السحاحة فيزول لون النشاء الأزرق الناتج من تفاعله . مع اليود شيئاً فشيئاً بإضافة المحلول المختزل حتى تمام المعايرة . أو يستخدم بدلاً من النشاء رابع كلوريد الكربون الذي يذيب اليود مكوناً محلولاً بنفسجياً واضحاً ولو بوجود نسب ضئيلة جداً منه وفي عملية المعايرة باستخدام CCl4 يوضع محلول اليود مع ما يكفي من يوديد البوتاسيوم في دورق محكم السد ويضاف إليه 5 - 10 مل من CC فيرســب هـذا القدر من السائل في قاع الإناء طبقة بنفسجية محملة باليود . ثم تبدأ المعايرة بإضافة محلول المادة المختزلة من السحاحة مع الرج فيختفي لون الطبقة العضوية تدريجياً حتى إذا ما خف اللون كثيراً تضاف قطرات المحلول من السحاحة قطرة فقطرة مع سد الدورق ورج المخلوط عقب كل إضافة حتى تكفي قطرة تزيل من الدليل في قاع المخلوط دلالة على تمام التفاعل
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


