
الذرات والجزيئات Atoms and Molecules
 المؤلف:
فياض محمد شريف
المؤلف:
فياض محمد شريف
 المصدر:
علم الحياة الكمومي
المصدر:
علم الحياة الكمومي
 الجزء والصفحة:
(ص83 – ص86)
الجزء والصفحة:
(ص83 – ص86)
 2023-04-09
2023-04-09
 4039
4039
الوحدة التركيبية لأي عنصر هي الذرة. الذرة هي أصغر منظومة للعنصر وتحتفظ بخواصه. تتكون الذَّرة من نواة ثقيلة في المركز يدور حولها إلكترون واحد أو أكثر في مدارات محددة بعيدة عن النواة. النواة تتألف من بروتون واحد كما في عنصر الهيدروجين أو بروتونات ونيوترونات في بقية العناصر الكيميائية. الإلكترونات تدور حول النواة بعيدًا عنها مُشكّلة غيمة تحتل معظم فضاء الذرة، الذي يزيد عن قطر النواة 100000 مرة، كتقريب مثل نسبة حبة البازلاء إلى ساحة سباق الخيل.
البروتون والنيوترون متساويان تقريبًا في الكتلة التي تساوي 24–10 × 1.67 غم، واصطلح العلماء على اعتبارها وحدة الكتلة الذرية أو 1 دالتون. البروتون يحمل شحنة موجبة، بينما يكون النيوترون متعادلا لا يحمل شحنة.
الإلكترون ذو كتلة صغيرة جدًّا تساوي 28–10 × 9.11 غم أو 1840/1 دالتون، ويحمل شحنة كهربائية سالبة. وهكذا ستكون كتلة الذرة أو ما يُعرف بعدد الكتلة مساويًا لمجموع كتل أو عدد البروتونات والنيوترونات. وهذه البروتونات والنيوترونات قابلة للتحول أحدهما إلى الآخر عند اختلال عددهما؛ فعدد الكتلة لذرة الهيدروجين التي تتألف نواتها من بروتون واحدٍ سيكون 1، بينما عدد الكتلة لذرة الهليوم التي نواتها تتألف من 2 بروتون و2 نيوترون سيكون 4 وهكذا. إن التنافر الموجود بين البروتونات بسبب تماثل شحناتها الموجبة يحول دون اندماجها. لكن بسبب اصطدامها المباشر الناتج عن سرعتها الفائقة في قلب النجم وبسبب وجود النيوترونات التي تساعد على التصاقها تتشكل نواة الذرة. عدد الكتلة يؤثّر في الخواص الفيزيائية للعنصر.
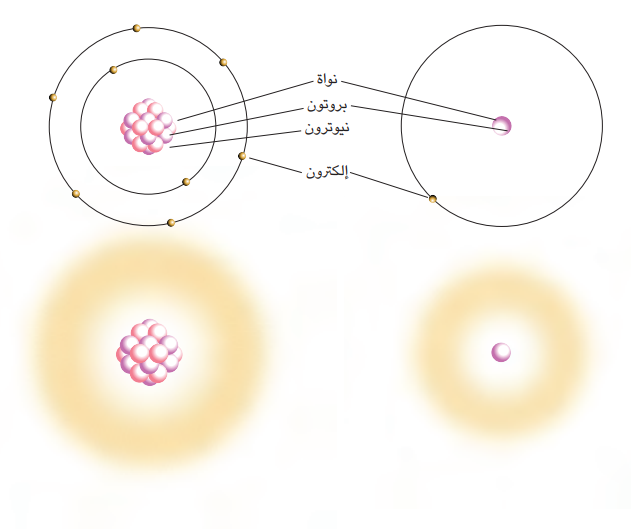
شكل 4-2: رسم تخطيطي تقليدي لذرة الهيدروجين (أعلى يمين) وذرة الأوكسجين (أعلى يسار) ورسم تخطيطي للذَّرتَين أقرب للحقيقة حيث تظهر السحابة الإلكترونية (أسفل يمين وأسفل يسار).
في الذرة عدد البروتونات يكون مساويًا لعدد الإلكترونات ويُعرف بالعدد الذري. وبذلك ستكون النواة ذات شحنة موجبة، بينما الذرة ككل تكون غير مشحونة (متعادلة)؛ لوجود عدد من الإلكترونات مساويًا لعدد البروتونات. العدد الذري سيُحدد الخواص الكيميائية للعنصر من خلال فقدان أو اكتساب إلكترونات أو الاشتراك بها مع ذرات أخرى فيما يُعرف بالتفاعل الكيميائي.
تدور الإلكترونات في مداراتٍ محدَّدةٍ حول النواة حسب طاقتها وعددها. المدار الأقرب للنواة هو الأقل طاقة. بينما تزداد طاقة المدارات كلما ابتعدت عن النواة؛ حيث يكون المدار الخارجي هو الأكثر طاقة تحت الظروف القياسية يتم إشغال المدار الأقرب للنواة أولًا، والذي يتسع إلى 2 إلكترون، بينما يتسع المدار الثاني إلى 8 إلكترونات، والمدار الثالث إلى 18 إلكتروناً، ويبقى المدار الخارجي للذرة الذي يحدد تكافؤ العنصر متغير عدد الإلكترونات بما لا يزيد عن سعة المدار (شكل 4-2). يمكن أن ينتقل الإلكترون من مداره إلى المدار الأكثر طاقة.
إذا حصل على طاقة فوتون، ويمكن أن يعود إلى المدار الأقل طاقة إذا فقد الطاقة محررًا فوتونا وتميل الذرة إلى الحالة الأكثر استقرارًا لمداراتها الخارجية، عن طريق فقدان أو اكتساب الإلكترونات أيهما أيسر طاقيًا. في حالة الذرات التي تكون مداراتها الخارجية غير مشبعة (عدد الإلكترونات أقل من سعة المدار) فإنها ستفقد أو تكتسب إلكتروناً واحدًا أو أكثر، وتتحول إلى أيون وهو ذرة مشحونة؛ فذرة عنصر الصوديوم مثلا وعددها الذري 11 يحتوي مدارها الخارجي على إلكترون واحد. فقدان هذا الإلكترون أيسر طاقيًا من اكتساب 7 إلكترونات لإشباع المدار؛ وعليه فإنها تفقد الإلكترون وتتحول إلى أيون موجب (Cation). أما ذرة الكلور أو الفلور ذات العدد الذري 17 و9 على التوالي، فمدارها الخارجي يحتوي على 7 إلكترونات. وهكذا فإن اكتساب إلكترون واحد لإشباع المدار أيسر طاقيًّا من فقدان 7 إلكترونات للوصول إلى حالة الاستقرار الطاقي. وهكذا ستتحول ذرة الفلور أو الكلور إلى أيون سالب (Anion). وفي الشكل 4-3 تنحو ذرة الهيدروجين أو الليثيوم إلى إشباع المدار الخارجي لها باكتساب إلكترون عن طريق المشاركة به مع ذرةٍ أخرى وتكوين أصرة تساهمية، أو فقدان الإلكترون وتكوين أيون موجب (بروتون). كذلك في المجموعة 14 من الجدول الدوري، لذرة الكاربون والسيليكون 4 إلكترونات في مدراتها الخارجية، ويمكنها اكتساب أو المشاركة بإلكترونات مع ذرات أخرى لتكوين جزيئات. وهكذا تعتبر مثل هذه العناصر نشطة كيميائيًّا يمكّنها من التفاعل مع الذرات أو الجزيئات الأخرى. في حين أن ذرات الهيليوم والنيون والأركون في المجموعة 18 ذات مدارات خارجية مشبعة؛ وبالتالي فهي ليست بحاجة إلى فقدان أو اكتساب إلكترونات، وبذا تكون عناصر غير نشطة كيميائيا.

شكل 4-3 توزّع الإلكترونات لعناصر تعود إلى 4 مجاميع من الجدول الدوري حسب مخططات بور.
 الاكثر قراءة في الفيزياء الذرية
الاكثر قراءة في الفيزياء الذرية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


