النبات

مواضيع عامة في علم النبات

الجذور - السيقان - الأوراق

النباتات الوعائية واللاوعائية

البذور (مغطاة البذور - عاريات البذور)

الطحالب

النباتات الطبية


الحيوان

مواضيع عامة في علم الحيوان

علم التشريح

التنوع الإحيائي

البايلوجيا الخلوية


الأحياء المجهرية

البكتيريا

الفطريات

الطفيليات

الفايروسات


علم الأمراض

الاورام

الامراض الوراثية

الامراض المناعية

الامراض المدارية

اضطرابات الدورة الدموية

مواضيع عامة في علم الامراض

الحشرات


التقانة الإحيائية

مواضيع عامة في التقانة الإحيائية


التقنية الحيوية المكروبية

التقنية الحيوية والميكروبات

الفعاليات الحيوية

وراثة الاحياء المجهرية

تصنيف الاحياء المجهرية

الاحياء المجهرية في الطبيعة

أيض الاجهاد

التقنية الحيوية والبيئة

التقنية الحيوية والطب

التقنية الحيوية والزراعة

التقنية الحيوية والصناعة

التقنية الحيوية والطاقة

البحار والطحالب الصغيرة

عزل البروتين

هندسة الجينات


التقنية الحياتية النانوية

مفاهيم التقنية الحيوية النانوية

التراكيب النانوية والمجاهر المستخدمة في رؤيتها

تصنيع وتخليق المواد النانوية

تطبيقات التقنية النانوية والحيوية النانوية

الرقائق والمتحسسات الحيوية

المصفوفات المجهرية وحاسوب الدنا

اللقاحات

البيئة والتلوث


علم الأجنة

اعضاء التكاثر وتشكل الاعراس

الاخصاب

التشطر

العصيبة وتشكل الجسيدات

تشكل اللواحق الجنينية

تكون المعيدة وظهور الطبقات الجنينية

مقدمة لعلم الاجنة


الأحياء الجزيئي

مواضيع عامة في الاحياء الجزيئي


علم وظائف الأعضاء


الغدد

مواضيع عامة في الغدد

الغدد الصم و هرموناتها

الجسم تحت السريري

الغدة النخامية

الغدة الكظرية

الغدة التناسلية

الغدة الدرقية والجار الدرقية

الغدة البنكرياسية

الغدة الصنوبرية

مواضيع عامة في علم وظائف الاعضاء

الخلية الحيوانية

الجهاز العصبي

أعضاء الحس

الجهاز العضلي

السوائل الجسمية

الجهاز الدوري والليمف

الجهاز التنفسي

الجهاز الهضمي

الجهاز البولي


المضادات الميكروبية

مواضيع عامة في المضادات الميكروبية

مضادات البكتيريا

مضادات الفطريات

مضادات الطفيليات

مضادات الفايروسات

علم الخلية

الوراثة

الأحياء العامة

المناعة

التحليلات المرضية

الكيمياء الحيوية

مواضيع متنوعة أخرى

الانزيمات
Insulin Mechanism
المؤلف:
Denise R. Ferrier
المصدر:
Lippincott Illustrated Reviews: Biochemistry
الجزء والصفحة:
21-11-2021
1693
Insulin Mechanism
Insulin binds to specific, high-affinity receptors in the cell membrane of most tissues, including liver, muscle, and adipose. This is the first step in a cascade of reactions ultimately leading to a diverse array of biologic actions (Fig. 1).

Figure 1: Mechanism of action of insulin. = phosphate; Tyr = tyrosine; S-S = disulfide bond.
1. Insulin receptor: The insulin receptor is synthesized as a single polypeptide that is glycosylated and cleaved into α and β subunits, which are then assembled into a tetramer linked by disulfide bonds (see Fig. 1). The extracellular α subunits contain the insulin-binding site. A hydrophobic domain in each β subunit spans the plasma membrane. The cytosolic domain of the β subunit is a tyrosine kinase, which is activated by insulin. As a result, the insulin receptor is classified as a tyrosine kinase receptor.
2. Signal transduction: The binding of insulin to the α subunits of the insulin receptor induces conformational changes that are transmitted to the β subunits. This promotes a rapid autophosphorylation of specific tyrosine residues on each β subunit (see Fig. 1). Autophosphorylation initiates a cascade of cell-signaling responses, including phosphorylation of a family of proteins called insulin receptor substrates (IRS). At least four IRS have been identified that show similar structures but different tissue distributions. Phosphorylated IRS proteins interact with other signaling molecules through specific domains (known as SH2), activating a number of pathways that affect gene expression, cell metabolism, and growth. The actions of insulin are terminated by
dephosphorylation of the receptor.
3. Membrane effects: Glucose transport in some tissues, such as muscle and adipose, increases in the presence of insulin (Fig. 2). Insulin promotes movement of insulin-sensitive glucose transporters (GLUT-4) from a pool located in intracellular vesicles to the cell membrane. [Note: Movement is the result of a signaling cascade in which an IRS binds to and activates a kinase (phosphoinositide 3-kinase), leading to phosphorylation of the membrane phospholipid phosphatidylinositol 4,5-bisphosphate (PIP2) to the 3,4,5-trisphosphate form (PIP3) that binds to and activates phosphoinositide-dependent kinase 1. This kinase, in turn, activates Akt (or protein kinase B), resulting in GLUT-4 movement.] In contrast, other tissues have insulin-insensitive systems for glucose transport (Fig. 3). For example, hepatocytes, erythrocytes, and cells of the nervous system, intestinal mucosa, renal tubules, and cornea do not require insulin for glucose uptake.
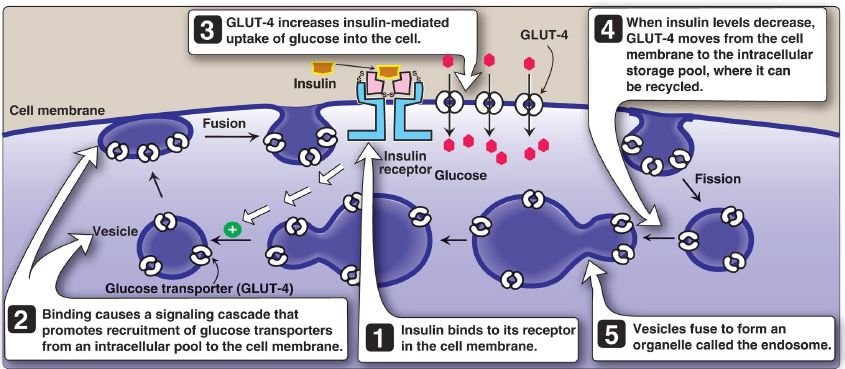
Figure 2: Insulin-mediated recruitment of GLUT-4 from intracellular stores to the cell membrane in skeletal and cardiac muscle and adipose tissue. S-S = disulfide bond.
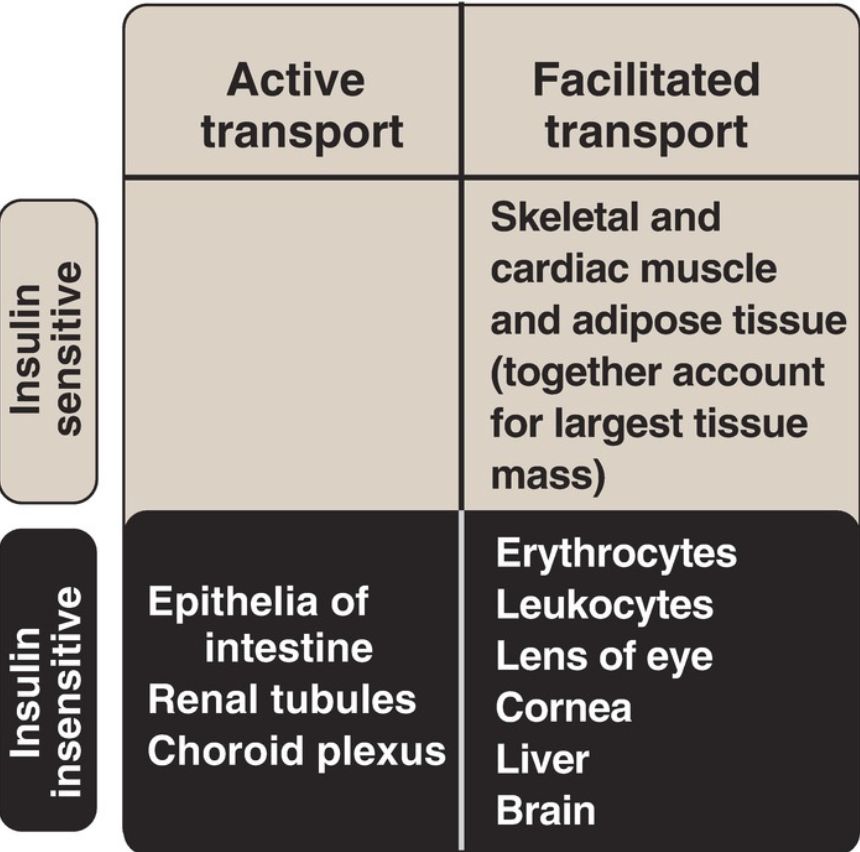
Figure 3: Characteristics of glucose transport in various tissues.
4. Receptor regulation: Binding of insulin is followed by internalization of the hormone–receptor complex. Once inside the cell, insulin is degraded in the lysosomes. The receptors may be degraded, but most are recycled to the cell surface. [Note: Elevated levels of insulin promote the degradation of receptors, thereby decreasing the number of surface receptors. This is one type of downregulation.]
5. Time course: The binding of insulin provokes a wide range of actions. The most immediate response is an increase in glucose transport into adipocytes and skeletal and cardiac muscle cells that occurs within seconds of insulin binding to its membrane receptor. Insulin-induced changes in enzymic activity in many cell types occur over minutes to hours and reflect changes in the phosphorylation states of existing proteins. Insulin-induced increase in the amount of many enzymes, such as glucokinase, liver pyruvate kinase, acetyl coenzyme A (CoA) carboxylase (ACC), and fatty acid synthase, requires hours to days.
These changes reflect an increase in gene expression through increased transcription (mediated by sterol regulatory element–binding protein-1c) and translation.
 الاكثر قراءة في الكيمياء الحيوية
الاكثر قراءة في الكيمياء الحيوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)