

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
لا يحمل الحمض الاميني أية شحنة عند درجة نقطة التعادل الكهربائي (pI)
المؤلف:
د. روبرت موراي وآخرون
المصدر:
هاربرز في الكيمياء الحيوية
الجزء والصفحة:
ص 88
2-4-2021
5332
لا يحمل الحمض الاميني أية شحنة عند درجة نقطة التعادل الكهربائي (pI)
تمثل الأشكال الكهرساوية (الزويتر ايون Zwitter ions) للأحماض الأمينية الأليفاتية (مثل الألانين) كما هو موضح في ( الشكل 4-4 ) ، وتعرف درجة الباهاء (pH) الكهرساوية (عند نقطة التعادل الكهربائية) على أنها درجة الباهاء (pH) المتوسطة بين قيم pk على طرفي الشكل الكهرساوي ، ولا مجال لأي التباس في حسابها عندما يكوين للحمض الأميني مجموعتين متفارقتين فقط ، ففي الألانين مثلا قيمة 2.35 = (R-COOH) p و2*9.69 = (R-NH+) p ، وبالتالي فان قيمة الباهاء (pH) الكهرساوية (pI) تحسب كما يلي :
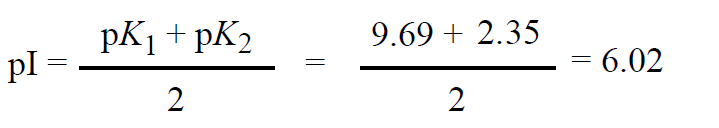
أما حساب هذه القيمة في المركبات التي تحتوي على أكثر من مجموعتين متفارقتين فيحمل احتمالا أكبر للخطأ ، فعلى سبيل المثال نطرح السؤال التالي : من خلال دراستك ( للشكل 4-5) ، ماذا يمكن أن تكوين قيمة الباهاء (pH) الكهرساوية لحمض الأسبارتيك ؟ للإجابة على هكذا تساؤل ، ارسم أولا كل الصيغ الأيونية الممكنة للمركب بالترتيب الذي يمكن أن توجد فيه مبتدئاً بالوسط شديد الأحماضة وحتى الوسط شديد القلوية (فمثلا يكوين ذلك بالنسبة لحمض الأسبارتيك كما هو موضح بالشكل 4-5) ، ثم حدد الصيفة التي تمثل الشكل الكهرلي المذبذب (Zwitterion) الذي تكوين عنده الشحنة الإجمالية مساوية للصفر ( الشكل 4-5 ب) وتكون pI هي الباهاء (pH) الوسط بين قيمتي الـ Pk على طرفي الشكل الكهرلي المذبذب ، وفي مثالنا :
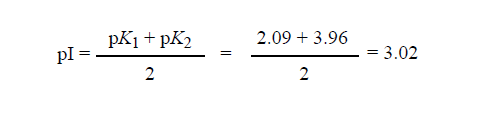

ويمكن تطبيق هذا الأسلوب أيضا على الأحماض الأمينية الحاوية على مجموعات تفارقية أكثر كالليسين أو الهيستيدين ، فبعد أن تكتب كل الصيغ المشحونة الممكنة للحمضين الأمينيين الليسين والأرجينين لاحظ أن :
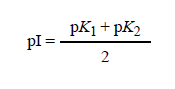
فتجد أن pI الأرجينين تساوي 9.7 وpI الليسين تساوي 10.8، وعلى الطالب حساب قيمة pI الهيستيدين.
ولا تقتصر طريقة تحديد قيم PK على جانبي الكهرل المذبذب بتفحص الصيغ المشحونة على الأحماض الأمينية ، بل يمكن تطبيقه لحساب شحنة الجزيئات الحاوية على أي عدد من الزمر المتفارقة. ولهذه الإمكانية أهميتما في المختبرات السريرية حيث يسمح بتوقع حركية المركبات في الحقول الكهربية وباختيار الدوارئ المناسبة لعمليات الفصل ؛ فعلى سبيل المثال ستفصل الدارئة ذات الباهاء PH = 7.0 أي جزيئين قيمة pI الخاصة بهما تساوي 6 و 8 على التوالي لأن الجزيء الأول (6-pI) سيحمل شحنة سلبية أكبر بكثير من تلك التي سيحملها الجزيء الثاني في درجة باهاء (7.0 = (pH ويمكن تطبيق الأمر نفسه لفهم طرق الفصل على الدعامات الأيونية (Ionic supports) كالمكاثير ذات الشحنة السالبة أو الموجبة (مثال : السلولوز DEAE والراتين دويكس 1 (Dowex 1 resin).
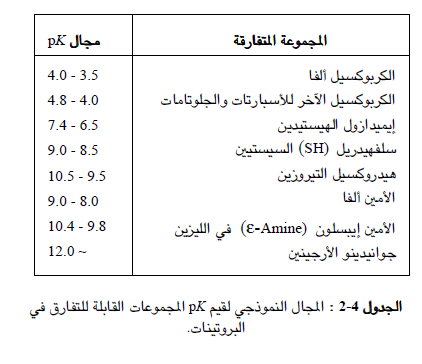
تختلف قيم pk تعبر قيم ال pk المدرجة في (الجدول 4-1) عن قيمتها في حالة الأحماض الأمينية الحرة الموجودة في الوسط المائي ، وهي بذلك تقدم لنا دليلا تقريبيا فقط عن قيم pk للأحماض الأمينية الموجودة في البروتينات ، والسبب في ذلك يعود إلى حقيقة أن البيئة المحيطة بأي مجموعة قابلة للتفارق تؤثر في قيمة pk الخاصة بهذه المجموعة ؛ فمن أجل الزوج المقترن حمض - أساس ، تدعم الأوساط القطبية وجود الشكل المشحون منه (مثال : -R-COO أو +R-NH3© بينما تدعم الأوساط الاقل قطبية الشكل غير المشحون منه (مثال : R-COOH أو R-NH)، وبالتالي فإن الأوساط القطبية ترفع قيمة pK الزمرة الكربوكسيلية وتخفض قيمة pK الزمرة الامينية. ومن جهة أخرى ، يؤثر وجود مجموعات مشحونة مجاورة أيضاً على قيم الـ pK ، ولكن لهذا التأثير , أن يتدعم تأثير المذيب أو يعاكسه. وكنتيجة لكل ذلك ، فإن قيمة pK الخاصة بمجموعة وظيفية معينة ستختلف من بروتين الى أخر وضمن البروتين نفسه أيضا (حسب مكان توضعها) ، وقد تشمل هذه الاختلافات كل وحدات الباهاء (pH) أو عددا منها أحياناً. ويدرج الجدول 4-2 المجال النموذجي لقيم pK الخاصة بالمجموعات الوظيفية القابلة للتفارق (التشرد) الموجودة في الأحماض الامينية المكونة للبروتينات علما أنه يمكن مصادفة قيم pK تختلف عن هذه القيم النموذجية بمقدار 3 وحدات باهاء (pH) في المواقع الفعالة للإنزيمات. ونذكر هنا مثالا شديد الوضوح على ذلك الا وهو قيمة باهاء (pH) حمض الأسبارتيك المنطمر في الثيوردوكسين والمساوية للقيمة 9 بانحراف يزيد عن 6 درجات باهاء (pH) !!
 الاكثر قراءة في الاحماض الامينية والبروتينات
الاكثر قراءة في الاحماض الامينية والبروتينات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















