

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Reaction Rates
المؤلف:
Jerome L. Rosenberg and Lawrence M. Epstein
المصدر:
College Chemistry
الجزء والصفحة:
p 144
19-7-2017
391
Reaction Rates
Consider a general reaction,
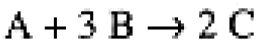 (1.1)
(1.1)
We describe the rate of the reaction in terms of the rate of disappearance of one of the reactants or the rate of appearance of the product,

The stoichiometry of the reaction tells us that in time interval Δt, Δ[B] = 3 Δ[A], Δ[C] = - 2 Δ[A]; furthermore, Δ[A] and Δ[B] are negative, Δ[C] is positive. Thus we must include an appropriate sign and stoichiometric coefficient in expressing the rate of the reaction:
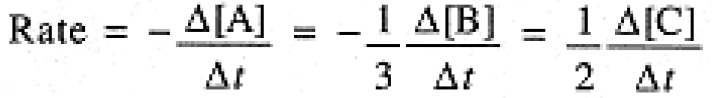 (1.2)
(1.2)
It is most common to express rates in terms of molar concentrations of species, even for gas-phase reactions. The usual units of a reaction rate are mol L-1s-1.
When a reaction is slow enough, it is appropriate to express the rate as the ratio of a concentration change, Δ[A], to a time interval, Δt, but when the reaction is faster, we consider the limit as Δt approaches zero, the first derivative of [A] with respect to time:
 (1.3)
(1.3)