

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الدليل على الآلية E2 . تأثيرات النظير
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 317
14-3-2017
1980
الدليل على الآلية E2 . تأثيرات النظير
Evidence of the E2 mechanism. Isotope effects
نأتي الآن إلى الدليل الثالث المبرهن على الآلية E2. تظهر تفاعلات الحذف من المرتبة – الثانية (جـ) تأثيراً نظائرياً هيدروجينياً كبيراً. ولفهم ما يعني ذلك، يجب علينا ان نعرف اولاً ما هو تأثير النظير وما هو اهميته بشكل عام.
تملك النظائر المختلفة لنفس العنصر بالتعريف نفس التشكيل الالكتروني وبالتالي تملك خواصاً كيميائية متشابهة. يعد هذا التشابه الأساس الذي تقوم عليه تقنية القائف النظيري isotopic tracer. ويستطيع نظير معين ان يقوم تماماً بما يقوم به النظير الآخر ولكن يمكن بوساطة قدرته الإشعاعية او كتلته غير العادية ان يجري تقفيه في تسلسل كيميائي.
ومع ذلك ، فإن النظائر المختلفة تملك بالتعريف كتلاً مختلفة. ولذلك تكون خواصها الكيميائية غير متماثلة: حيث تحدث نفس التفاعلات الكيميائية عادة، ولكن بسرعات مختلفة إلى حد ما (أو لتفاعلات عكوسة، مع مواضع مختلفة للتوازن). وان الاختلاف في السرعة (او في موضع التوازن) الناجم عن اختلاف النظير الموجود في منظومة التفاعل يدعى بتأثير النظير.
تقود الدراسات النظرية والتي لا مجال للدخول فيها والمدعمة بالتجارب العملية الإيضاحية الكثيرة، إلى الاستنتاج التالي: إذا كان ارتباط ذرة معينة في الحالة الانتقالية اضعف من ارتباطها في المادة المتفاعلية في تفاعل معين فإن التفاعل الذي يتضمن ارتباط نظير أثقل من الذرة السابقة سيجري ببطء اكبر ، تملك نظائر الهيدروجين اكبر الاختلافات المتناسبة مع الكتلة : يكون الديتريوم (D) أثقل بمرتين من البروتيوم (H) ويكون التريتيوم (T) أنقل بثلاث مرات لذلك، وبالنتيجة يكون تأثير النظير في الهيدروجين هو الأكبر والأسهل قياساً وبسبب الاهمية الخاصة للهيدروجين في الكيمياء العضوية فهو الأكثر دراسة.
سنهتم في هذا الكتاب بالتأثيرات الأولية لنظائر الهيدروجين والتي تتضمن : تكسر الرابطة مع البرونيوم (H) بسرعة اكبر من الرابطة مع الديتريوم (D) ، وفي التفاعلات الكثيرة التي من هذا النوع.
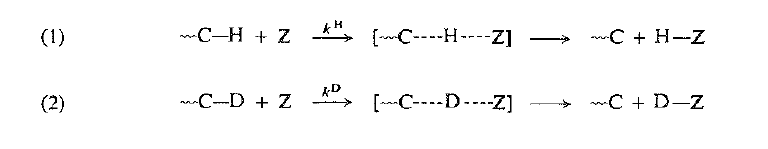
ينزع الهيدروجين على شكل ذرة أو أيون موجب أو أيون سالب ويصل تأثير نظير الديتريوم (kH/kD) على ما قيمته 5 إلى 8 (في درجة حرارة الغرفة) الامر الذي يمكننا من القول ان التفاعل في حالة الهيدروجين اسرع بمعدل 5 إلى 8 مرات من الديتريوم (تأثير نظير التريتيوم kH/kT أكبر بمرتين من تأثير نظير الديتريوم).
يمكن قياس هذه الفروقات في السرعة بطرائق مختلفة، إذ يمكن في بعض الحالات قياس سرعتي تفاعلين منفردين (1) و (2) مباشرة ومقارنة ثابتي السرعة KH و KD ولكن غالباً يكون، من الأفضل استعمال طريقتنا المعروفة في التنافس في أي من الطريقتين.
في تفاعلات التنافس بين الجزيئات لمزيج موسوم وغير موسوم تتنافس المتفاعلات على كمية محددة من الكاشف، يجري التفاعلات (1) و (2) في نفس المزيج ثم نقيس الكمية النسبية للمنتجات H – Z و D – Z ( في بعض الاحيان، تستخدم مركبات اكبر من الكاشف Z ، ثم نقيس الكمية النسبية للمادتين المتفاعلتين العادية والموسومة غير المستهلكه حث تسود المادة الاولية الأقل تفاعلية والتي تكون اكثر بطئاً، وتحسب السرعات النسبية للتفاعل دون اي صعوبة).
في تفاعلات – التنافس – الجزيئية الداخلية تستخدم مادة متفاعلة وحيدة تحتوي على عدة مراكز متكافئة بعضها موسوم وبعضها الآخر غير موسوم.

حيث تبين قياس الكمية النسبية لــ H – Z و D – Z أو قياس الكمية النسبية للمنتج الحاوي على (D) المتشكل من التفاعل (3) والمنتج الحاوي على (H) المتشكل من التفاعل (4).
إن وجود او غياب تأثير النظير في تفاعل معين يمكن ان يكون ذا أهمية كبيرة للكيميائية العضوي. وكمثال أولي على كيفية استعمال هذا المفهوم دعنا نعود إلى موضوعنا الأصلي وهو الدليل الذي يدعم الآلية E2.
دعنا ندرس مستبدل هاليد الالكيل بروميد -2 فنيل الاتيل C6H5CH2CH2Br تشتق زمرة الفنيل من مركب البنزين العطري C6H6 (يمكن تمثيل الفتيل احياناً بــ -ph) نحتاج فقط في الوقت الحاضر إلى معرفة ان الزمرة –C6H5 نفسها خاملة تجاه الكواشف التي تحدث الحذف ويمكن عدها مجرد مستبدل آخر.
حضر المركب بروميد -2 فنيل الاتيل C6H5CD2CH2Br الموسوم الذي يحيو الديتريوم في كلا الموضعين B- وهما الموضعان اللذان يجب ان يفقد منهما الهيدروجين اثناء الحذف. عين ثابت السرعة (KD) لنزع بروميد الهيدروجين باستخدام ايتوكسيد الصوديوم، ثم قورن هذا الثابت مع ثابت السرعة (KH) الخاص بتفاعل بروميد -2 فتيل الإتيل غير الموسوم وفي نفس الشروط. لقد وجد أن kH/kD =7 وهذا يعني ان المركب الذي يحوي البروتيوم بتفاعل اسرع بسبع مرات من المركب الذي يحوي الديتريوم. سوف نرى ان تأثير نظير من هذا الحجم ما هو ما نتوقعه فعلاً عند كسر الرابطة كربون – هيدروجين.
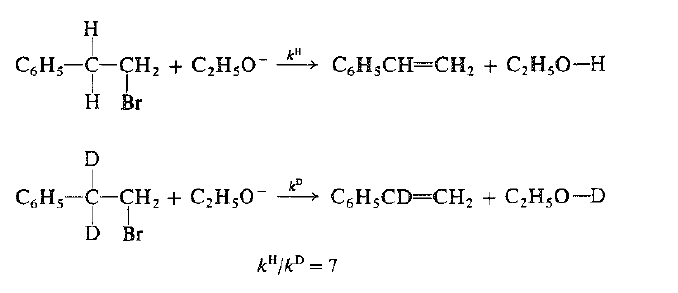
الآن، ما أهمية وجود تأثير النظير هنا؟ فهو لا يستعمل لبيان كسر الرابطة – B كربون – هيدروجين فنحن نعلم ذلك سلفاً من منتجات التفاعل. ولكن المهم هو ان ذلك التأثير يبين كسر الرابطة B- كربون – هيدروجين في الخطوة المحددة لسرعة التفاعل . إن هذه الحقيقة تتفق تماماً مع الآلية التي تبين أن الرابطة B- كربون – هيدروجين تنكسر فقط في الخطوة المحددة لسرع التفاعل.