

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
التفاعل SN2 : دور المذيب . المذيبات البروتونية واللابروتونية
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 281 - 6th ed
5-3-2017
6347
التفاعل SN2 : دور المذيب . المذيبات البروتونية واللابروتونية
The SN2 reaction : roin of the solvent , protic and aprotic solvents
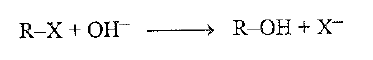
لنعد الآن إلى التفاعل SN2 ، ونرى كيف يتأثر بالمذيب لندرس المنظومة التي تعد حتى الآن الأكثر عمومية. وهي المنظومة التي تكون فيها الركيزة جزيئاً معتدلاً ويكون النوكليوفيل انيوناً: مثلاً ، التفاعل بين هاليد الالكيل وأيون الهيدروكسيد :
لنبدأ كما فعلنا مع الــ SN1 ، ونرى كيفية حدوث التفاعل على نحو عادي، في المحلول ، ونقارنه مع التفاعل في الطور الغازي، اي بدون مذيب على الاطلاق . لقد وجد للمرة الثانية، أن المذيب يمارس تأثيراً قوياً، ولكن في الاتجاه المعاكس. حيث يسرع المذيب التفاعل SN1 بشكل هائل، لوكنه يبطئ التفاعل SN2 إلى حد كبير، بنحو 2010 !
الآن، كيف نستطيع ان تفسر هذا الانقلاب المفاجئ ؟ وكما يحدث دائماً عند التعامل مع التأثير على سرعة التفاعل، يجب ان نقارن المتفاعلات مع الحالة الانتقالية، وهذه المرة، يجب ان نرى كيف يتأثر كل منها بالمذيب. وبالتحديد، توجد مادتان متفاعلتان للدراسة في الخطوة الحالية لسرعة التفاعل في تفاعل الــ SN2 : هنا، هاليد الالكيل وأيون الهيدروكسيد. كما رأينا، يملك هاليد الألكيل عزم ثنائي قطب وبشكل روابط ثنائي قطب – ثنائي قطب ضعيفة مع المذيب. يحمل ايون الهيدروكسيد شحنة سالبة كاملة، وبشكل روابط ثنائي قطب – ثنائي قطب ضعيفة مع المذيب . يحمل ايون الهيدروكسيد شحنة سالبة كاملة، وبشكل روابط ايون – ثنائي قطب قوية جداً مع المذيب. وتحمل الحالة الانتقالية شحنة سالبة كاملة، ايضاً، لكن الشحنة هنا موزعة بين الهيدركسيل المهاجم والهاليد المغادر.

ويكون ارتباط المذيب بهذه الشحنة المشتتة اضعف بكثير من ارتباطه بالشحنة المركزة التابعة لأيون الهيدروكسيد الصغير، لذلك يؤدي المذيب إلى استقرار المتفاعلات – وخصوصاً النوكليوفيل – اكثر مما يؤدي إلى استقرار الحالة الانتقالية ، برفع الـ Eact ويبطء التفاعل (الشكل 1.1) لذلك يكون هنا تذوب النوكليوفيل الانيوني هو العامل المهيمن. فيجعله مستقراً – نسبة إلى الحالة الانتقالية – يقوم المذيب بتخميل النوكليوفيل . لقد قيس فعلياً تخميل النوكليوفيل بالمذيب، جزيء بجزيء . ودرس تفاعل بروميد المتيل في الطور الغازي مع ايونات هيدروكسيد مميهة إلى درجات مختلفة . وحصل على النتائج التالية :

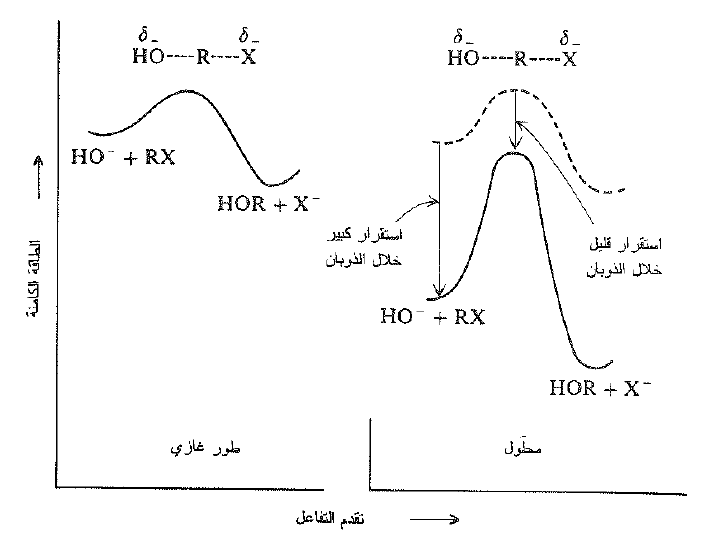
الشكل 1.1 تأثير المذيب في سرعة هجوم ايون الهيدروكسيد على هاليد الالكيل. يملك النوكليوفيل شحنة مركزة أكثر من الحالة الانتقالية. ويكون اكثر استقراراً بالروابط ايون – ثنائي قطب.
نرى ابتداء من المنظومة الخالية من الماء إنه عند زيادة عدد جزيئات الماء نسبة إلى أيون الهيدروكسيد تنخفض سرعة التفاعل بشكل ثابت واخيراً تهبط السرعة في المحلول إلى جزء صغير من قيمتها الأولية.
ولكن تختلف قوة التذوب من انبون إلى انبون، وكذلك يختلف التحميل الذي بسببه . لندرس تفاعل بروميد المتيل مع ايونات هاليد مختلفة.
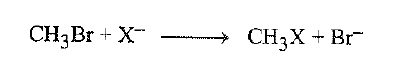
في الطور الغازي، يوضح ترتيب تفاعلية ايونات الهاليد -F-> Cl> Br-> I قوة الرابطة C – X المتشكلة ، ولكن ، ينعكس ترتيب التفاعلية في محللو الميتانول ويصبح F-< Cl-< Br-< I
ويكون تفسير ذلك سهلاً. إذ تختلف قوة التذوب من انبون إلى آخر، وتختلف معه درجة التخميل. يكون الفوريد هو الهاليد الاصغر، والأكثر تركيزاً للشحنة، وكما رأينا (الفقرة 4.7) فهو يشكل الروابط ايون – ثنائي قطب الاقوى – روابط هيدروجينية في الميتانول – وبالتالي يكون هو الهاليد الاكثر تحميلاً ويكون اليوديد اكبر هذه الهاليدات له شحنة مشتتة، فهو الاقل قوة على التذوب وبالتالي الأقل تخميلاً. لا نقارن في الميتانول بين ايون فلوريد عار، ولكننا نقارن بين ايون فلوريد مذوب بقوة مع ايون يوديد ضعيف التذوب. يكون اليوديد الاسرع تفاعلاً ليس – كما يعتقد – بسبب تفاعليته الكامنة، ولكن بسبب كونه الأقل تذوباً. بعد المذيب الجزء المتمم لبنية الجزيء المذوب ويكون ايون الفلوريد في الميتانول كاشفاً مختلفاً عن ايون الفلوريد وهو في الحالة الغازية – وفي هذه المسألة – من أيون الفلوريد في الــ DMF. ونلاحظ ترتيبين مختلفين للتفاعلية في التفاعل مع بروميد المتيل لأننا نتعامل مع شكلين مختلفين للنوكليوفيل : غير مذوب ومذوب.
حتى الآن، كنا نناقش الفرق في التفاعل SN2 عند غياب وعند وجود المذيب. الآن، ما هو تأثير الانتقال من مذيب معين إلى مذيب آخر؟
عموماً ، عند المقارنة بين مذيبات متشابهة نجد انه كلما ازدادت القطبية ازداد بشيء التفاعل، ويكون الاستقرار الحاصل بالمذيب الأكثر قطبية اقوى على الانيونات النوكليوفيلية من اجل الحال الانتقالية. وتزداد الــ Eact (مرة اخرى يكون هذا الأمر معاكساً لما شاهدناه في التفاعلات SN1).
ولكن تأثيرات هذه القطبية وحدها لا تكون كبيرة جداً ، وعلى عكس ذلك ، تكون تأثيرات التغير من مذيب لا بروتوني إلى مذيب مثيرة وغير مألوفة . تجري التفاعلات SN2 في مذيبات مثل ثنائي منيل السلفوركسيد DMSO، وثنائي متيل الفورم اميد DMF ، أو سداسي تيل فسفور ثلاثي الأميد HMPT أسرع بمليون مرة من الكحول او مزيج الكحول والماء. ومرة اخرى، يكون تذوب الانيون هو العامل الاهم : كلما كان تذوبه اكبر – نسبة إلى الحالة الانتقالية – كان التفاعل ابطأ . نحن نعلم ان التذوب هو العامل الأهم : كلما كان تذوبه اكبر – نسبة إلى الحالة الانتقالية – كان التفاعل ابطأ. نحن نعلم ان التوب الأقوى للانيونات، يكون عن طريق الربط الهيدروجيني – في بعض الاحيان يكون ممكناً في المذيبات البروتونية ولكن ليس في المذيبات اللابروتونية – تذوب المذيبات اللابروتونية بشكل رئيس الكواشف الايونية بوساطة ربطها للكاتيون، فهي تترك الانيون حراً نسبياً وعالي التفاعلية . يجب إلا ننسى، ضمنياً على الأقل، اننا نناقش التأثيرات في الأنيون نسبة إلى التأثيرات في الحالة الانتقالية. ويمكن تبرير تركيز اهتمامنا على الانيوم ببساطة بسبب ان التذوب هنا أكثر اهمية ، وعادة – ولكن ليس دائماً – تكون الاختلافات في التذوب على نفس الدرجة من الاهمية.