

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الارتباط الثانوي Secondary bonding
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 270 - 6th ed
21-2-2017
7519
الارتباط الثانوي Secondary bonding
تعرفنا في الفصل الأول يإيجاز، عند مناقشتنا للانصهار والغليان والذوبان، إلى القوى التي تمارس فعلها بين الجزيئات وبين الأيونات وبين الجزيئات والأيونات. ذكرنا سابقاً أن جميع هذه القوى هي قوى كهرسكانة اي جذب الموجب للسالب. وقوى التجاذب هذه أي "الروابط" هي التالية:
(أ) الروابط أيون – أيون : وهي التجاذب بين الشحنات المتعاكسة على الكاتيون والأنيون.

(ب) الروابط ثنائي قطب – ثنائي قطب: وهي التجاذب بين النهاية الموجبة لجزيء قطبي ما والنهاية السالبة لجزيء قطبي آخر.

إن الرابطة ثنائي قطب - ثنائي قطب الاكثر قوة هي الرابطة الهيدروجينية، التي تقوم فيها ذرة الهيدروجين بدور جسر بين ذرتين كهرسلبيتين (N, O, F) ، فهي ترتبط بإحداهما (أي مانحة الربط الهيدروجيني) برابطة تشاركية، بينما ترتبط بالأخرى (أي مستقبلة الربط الهيدروجيني) بتجاذب كهرساكن صرف . وفيما يلي أمثلة عن ذلك:
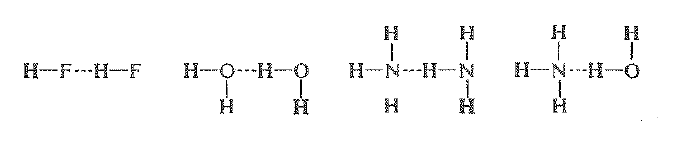
تعتمد قوة رابطة هيدروجينية ما على طبيعة مانح الرابطة الهيدروجينية كلما كان اكثر حموضة كلما كانت الرابطة الهيدروجينية اكثر قوة. تتوقف قوة الرابطة الهيدروجينية على مقدار إيجابية الهيدروجين (الفقرة 19.1) تتوقف الحموضة على مدى احتضان الأساس المترافق جيداً للشفع الالكتروني الذي يتركه البروتون الراحل وراءه. تزداد هاتان الحاصتان بالعامل نفسه وهو السحب الالكتروني في الزمرة المرتبطة بالهيدروجين. كلما كان المستقبل اكثر اساسية كلما كانت الرابطة الهيدروجينية اقوى. تتوقف قوة الرابطة الهيدروجينية على مقدار سلبية الذرة المستقبلية، أي على مقدار متاحية الكتروناتها ، ومتاحة الالكترونات تجعل الجزيء أساسياً.
(جـ) قوى فاندرفالس : يحرض التجاذب بين النهايات ذات الشحنات المتعاكسة تشكل ثنائيات أقطاب في الجزيئات المجاورة. تمارس هذه القوى فعلها بين جميع الجزيئات حتى الجزيئات اللاقطبية.

د) الروابط الأيونية – ثنائية القطب : وهي التجاذب الموجب والنهاية السالبة لجزيء المذيب القطبي. وبين الايون السالب والنهاية الموجبة لجزيء المذيب القطبي (الشكل 1.1).

الشكل 1.1 التأثر أيون – ثنائي قطب : الكاتيون والآنيون المذوبان
فيما عدا الروابط الأيونية المكتملة في البنية البلورية الأيونية، فإن قوى التجاذب هذه تدعى غالباً الروابط الثانوية.
وهي تمارس فعلها بين الجزيئات المختلفة والأيونات خلافاً للروابط التشاركية التي تعمل في الجزيء أو الأيون وتمسك الذرات ببعضها. تكون كل رابطة ثانوية ضعيفة نسبياً إذا أخذت منفردة. ولكن عندما تكون محتملة مع بعضها فإن فعلها يكون قوياً جداً. وسنرى ان تشكلها يمكن ان يوفر طاقة كافية لكسر رابطة تشاركية.
إذا كان الأمر مستغرباً فتذكر ما يلي: لجعل كلوريد الصوديوم يلغي علينا تسخينه حتى الدرجة 1413 ْس. اما عند درجة حرارة الغرفة فيمكننا ان نحله في لحظات معدودة بتحريكه تحريكاً بسيطاً في كأس فيه ماء. ومع ذلك فإن التغلب على القوى ما بين الأيونية في العمليتين كلتيهما هو نفسه تماماً.
سنهتم في هذا الفصل مبدئياً بالربط الثانوي ، لأن فعل المذيب يتضمن هذا الرابط، حيث يقوم المذيب بحل الدقائق المذابة وينشط تفاعليتها ، وحتى أنه يتفاعل معها بطريقة مباشرة. غير ان الربط الثانوي يكون متضمناً في تأثيرات اخرى غير تأثيرات المذيب. وهذه هي القوى نفسها التي تمارس فعلها بين الجزيئات الطويلة الشبيعة بالخيوط مثل القطن والصوف والحرير والنايلون، معطية القوة المطلوبة عند تشكل الألياف. حتى أن أضعف هذه القوى وهي قوى فاندرفالس التي تمارس فعلها بين السلاسل اللاقطبية للفوسفوليبيدات فإنه تعمل عمل الملاط في جدران الخلايا الحية.
يوجد الربط الثانوي ليس بين جزيئات مختلفة فقط، بل أيضاً بين أجزاء مختلفة من الجزيء نفسه. وهي تلعب بهذه الطريقة دوراً أساسياً في تعيين أشكال الجزيئات الضخمة مثل البروتينات والحموض النووية ، التي تعين أشكالها خواصها الحيوية. فحجم الفجوات في جزيء الهيموغلوبين مثلاً كبير بصورة تكفي لمسك زمر الهيم مع ذرات الحديد فيها الحاملة للأكسجين. أما الشكل اللولبي لجزيئات –a الكيراتين والكولاجين فهو الذي يجعل الصرف والحرير قويين، وأوتار العضلات والبشرة خشنة. إنه الارتباط الثانوي الذي يجعل اللولب المضاعف لــ DNA مضاعفاً، مما يسمح لجزيئاته التي تعد أساساً في الوراثة بالنسخ الذاتي.