

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المصادر الصناعية للإيترات . نزع الماء من الكحولات
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 257 - 6th ed
20-2-2017
4490
المصادر الصناعية للإيترات . نزع الماء من الكحولات
Industrial sources of ethers. Dehydration of alcohols
ثمة عدد من الإيترات المتناظرة التي تحتوي على زمر الكيلية أخفض تحضر على نطاق واسع لاستخدامها بصورة رئيسية كمذيبات. ويعد ثنائي إتيل الإيتر أعظمها أهمية وهو المذيب الشهير الذي نستخدمه في عمليات الاستخلاص وفي تحضير كواشف غرينيار، من بين الايترات الأخرى المهمة نذكر ثنائي إيزوبوبيل الإيتثر ونظامي بوتيل الإيتر.
تحضر هذه الإيترات بتفاعلات الكحولات المقابلة مع حمض الكبريت. وبما ان جزيء ماء واحد يفقد لكل زوجين من جزيئات الكحول فإن التفاعل يعد نوعاً من نزع الماء.

الجدول 1.1 : الإيترات
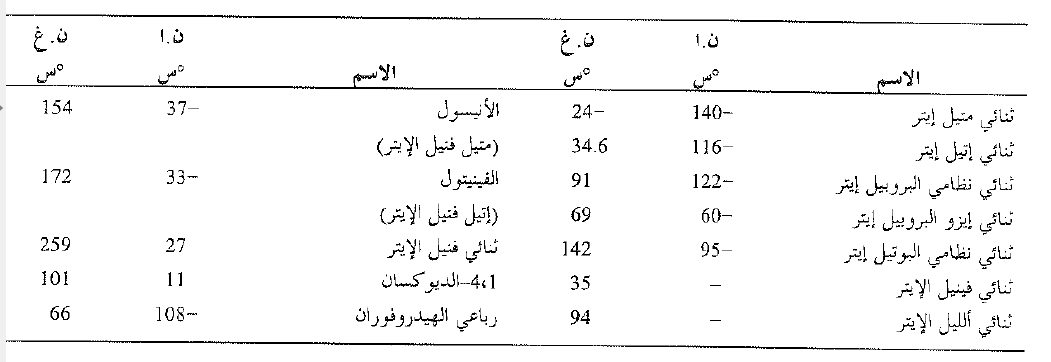
وكما سنرى قريباً يخضع الكحول إلى نوع آخر من نزع الماء، يشتمل على حذف، ويعطي الكنات. ويكون نزع الماء من الكحولات وتحولها إلى إيترات بدلاً من الالكنات محكوماً باختيار شروط التفاعل. فعلى سبيل المثال يحضر الإيتيلين بتسخين الكحول الإتيلي مع حمض الكبريت المركز حتى الدرجة 180 ْ س، أما ثنائي إتيل الإيتسر فإنه يحضر بتسخين مزيج الكحول الإتيلي وحمض الكبريت المركز حتى الدرجة 140 ْس وفي هذه الحالة يضاف الكحول باستمرار لإبقائه موجوداً بكمية زائدة.
يقتصر نزع الماء، على وجه العموم ، على تحضير الإيترات المتناظرة لأنه، كما يمكن ان نتوقع، تؤدي تركيبة من كحولين إلى مزيج من ثلاثة إبترات، عادة.
يعد تشكيل الإيتر بنزع الماء مثالاً على الاستبدال النوكليوفيلي ويقوم الكحول، في هذه الحالة، بدورين: بعد جزيء الكحول المبرتن هو الركيزة ، كما يعد جزيء كحول آخر نوكليوفيلاً. وقد يكون التفاعل SN1 أو SN2، ويعتمد ذلك على ما إذا كان الجزيء المبرتن يفقد الماء قبل هجوم جزيء الكحول الآخر أو بالتزامن مع الهجوم. ويحتمل ان تتبع الكحولات 2 ْ و 3 ْ النمط SN1.
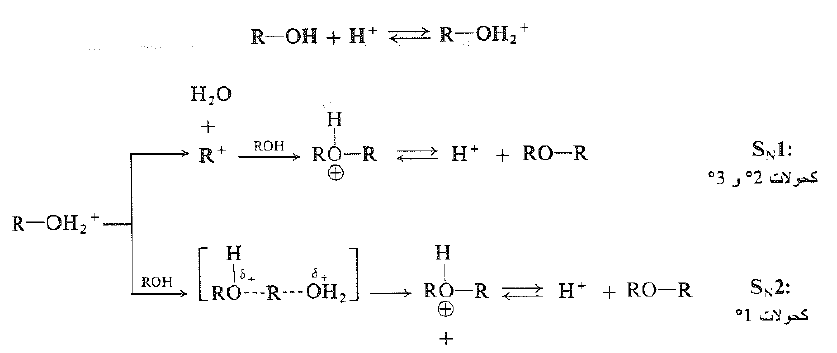
ومن جهة ثانية، يعطي كحول نظامي بوتيل ثنائي نظامي بوتيل الإيتر من غير إعادة ترتيب ومن ثم، على الارجح، من غير كاربو كاتيونات متوسطة ؛ ويبدو جلياً ان الكحولات 1 ْ هي الأقل مقدرة على تشكيل كاربوكاتيونات ولكنها هي الأكثر عرضة لهجوم جانبي خلفي بعد سلوك المسار SN2.
تتحول معظم الإيترات الأليفاتية، عند بقائها بملامسة الهواء، ببطء إلى بيروكسيدات غير مستقرة. وعلى الرغم من انها تكون موجودة بتراكيز منخفضة فقط، فإن هذه البيروكسيدات تكون خطيرة جداً لأنها قد تسبب انفجارات عنيفة أثناء التقطير الذي يلي ، عادة، الاستخلاص حتى بالإيتر.
يكتشف وجود البيروكسيدات من تشكل لون احمر عند خض الإيتر مع محلول مائي من سلفات الامونيوم والحديدي وتيوسيانات البوتاسيوم، تؤكسد البيروكسيدات أيون الحديدي إلى أيون الحديد ، الذي يتفاعل مع أيون التيوسبانات ويعطي اللون الاحمر الدموي المميز للمعقد.
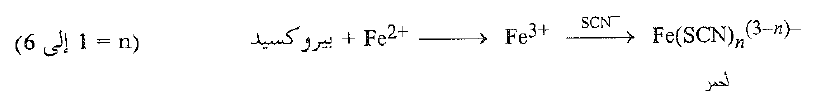
يمكن إزالة البيروكسيدات من الإيترات بعدد من الطرق، من بينها الغسل بمحاليل أيون الحديدي (الذي يرجع البيروكسيدات) أو بالتقطير من حمض الكبريت المركز (الذي يؤكد البيروكسيدات).
وينبغي لاستخدام الإيترات في تحضير كواشف غرينيار ان يكون الإيتر (عادة ثنائي إتيل) خالياً من أي أثر للماء والكحول . ويمكن تحضير هذا الإيتر الذي يدعى الإيتثر المطلق بتقطير الإيتر العادي من حمض الكبريت المركز (الذي لا يزيح فقط الماء والكحول بل يزيح ايضاً البيروكسيدات).
وحفظه بعد ذلك فوق الصوديوم المعدني. ويتوافر اليوم إيتر لا مائي تجاري يمتلك مثل هذه النوعية العالية ولا يحتاج الأمر إلا إلى المعالجة بالصوديوم فقط لجعل الإيتر جاهزاً لكواشف غرينيار.
تصعب الإحاطة بالأضرار التي يسببها استخدام ثنائي إيتيل الإيتر، حتى لو كان خالياً من البيروكسيدات : فهو شديد التطاير وقابلية اشتغال أبخرته تجعل اخطار الانفجارات والحرائق مائلة ما لم تتخذ احتياطات خاصة.