علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الخواص الفيزيائية للإيترات Physical properties of ethers
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 256 - 6th ed
19-2-2017
2268
الخواص الفيزيائية للإيترات Physical properties of ethers
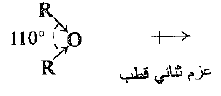
بما ان الزاوية C- O – C لا تساوي 180 ْ، فإن عزمي ثنائي القطب للرابطتين C – O لا يفنيان بعضها البعض، وبالتالي تملك الإيترات عزم ثنائي قطب صغير (على سبيل المثال D 1.18 من اجل ثنائي إتيل إيتر).
لا تؤثر هذه القطبية الضعيفة تأثيراً ملموساً في نقط غليان الإيترات التي تكون مماثلة تقريباً لنفس نقط غليان الالكانات التي تمتلك وزناً جزيئياً مشابهاً وأخفض كثيراً من نقط غليان الكحولات المماكبة. قارن، على سبيل المثال، نقط غليان نظامي الهبتان (98 ْس) ومتيل نظامي بنتيل الايتر (100 ْس) وكحول نظامي هكسيل (157 ْس) . فالربط الهيدروجيني الذي يشد جزيئات الكحول بقوة بعضها إلى بعض لا يكون ممكناً من اجل الايترات طالما انها تحتوي على هيدروجين مرتبط إلى كربون فقط .
تظهر الايترات ، من جهة ارى، ذوبانية في الماء يمكن مقارنتها مع ذوبانية الكحولات، فكل من ثنائي إتيل الايتر وكحول نظامي البوتيل، على سبيل المثال، ذوابان في الماء بالمقدار نفسه تقريباً 8 غ في كل 100 غ ماء. ونرجع ذوبانية الكحولات الاخفض في الماء إلى الربط الهيدروجيني بين جزيئات الملاء وجزيئات الكحول. وتحدث ذوبانية الايترات في الملاء بالطريقة نفسها: بوساطة اشفاع الالكترونات غير المشترك بها الموجودة لدى الاكسجين ، حيث تستطيع الايترات تقبل الروابط الهيدروجينية المقدمة من الماء.