

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الكحولات بوصفها حموضاً وقواعداً Alcohols as acids and bases
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 245 - 6th ed
19-2-2017
1292
الكحولات بوصفها حموضاً وقواعداً Alcohols as acids and bases
من بين الخواص الكيميائية المختلفة للكحولات ، ثمة خاصتان من الخواص تكون لهما الأولوية على جميع الخواص الاخرى: الحموضة والقاعدية. تكمن هذه الخواص، طبعاً، في الزمرة الوظيفية للكحولات : الزمرة الهيدروكسيلية –OH. وهذه الزمرة الهيدروكسيلية في الماء، ذلك المركب الذي نعرفه جيداً. وتعد الكحولات ، مثل الماء، حموضاً ضعيفة او قواعداً ضعيفة – وهي قريبة في حموضتها وقاعديتها من الماء.
الأكسجين ، بأزواجه الالكترونية غير المشترك بها هو الذي يجعل الكحول قاعدياً. فالكحولات ، مثل الماء، تكون قاعدية إلى حد استقبال بروتون من الحموض القوية، مثل كلوريد الهيدروجين وسلفات الهيدروجين، ومن ثم فإنها تجعل هذه الحموضة تامة التفارق تقريباً نكتب على سبيل المثال:

يكون الهيدروجين ، في الكحولات ، مرتبطاً إلى عنصر الأكسجين الشديد الكهرسلبية. وتسهل قطبية الرابطة O – H خروج البروتون؛ ويستوعب الأكسجين الكهرسلبي الشحنة السالبة من الالكترونات التي يتركها البروتون خلفه .
تظهر حموضة الكحولات في تفاعلها مع المعادن الفعالة حيث يتحرر غاز الهيدروجين.
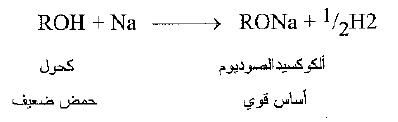
وتسمى المنتجات الكوكسيدات: نذكر على سبيل المثال ، ايتوكسيد الصوديوم وايزو بروبوكسي البوتاسيوم.
والآن ما مدى حموضة الكحولات ؟ تكون الكحولات، باستثناء الميتانول، اضعف حموضة، بعض الشيء، ن الماء. فعندما يضاف إلى الما إلى الكوكسيد يتشكل هيدروكسيد الصوديوم والكحول الوالد. فالحمض الأقوى H-OH، يزح، الحمض الأضعف، R – OH ، من ملحه.

وبلغة اخرى، يسحب الاساس القوى RO- ، البروتون بعيداً من الاساس الاضعف، فإذا تمسكت RO- بالبروتون لمسكاً أكثر متانة من تمسك HO- به، فإن RO-H ينبغي ان يكون حمضاً اضعف من HO-H.
تكون الكحولات، مثل الماء والامونيا ، حموضاً أقوى كثيراً جداً من الالكانات، وهي تزيحها من " أملاحها" بسهولة: تزيحها من كواشف غرينيار على سبيل المثال:
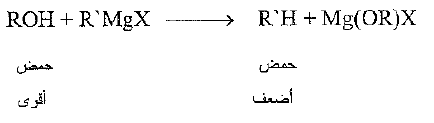
يمكن ، اعتماداً على ما سبق ، وضح الكحولات في تسلسل الحموضة نسبة إلى طوائف المركبات الاخرى. وعندما نفعل ذلك فإننا نصل بالضرورة، إلى ترتيب القاعدية النسبية للقواعد المترافقة المقابلة.

تعد الطريقة، التي شرحناها آنفاً لمقارنة الحموضات، طريقة عامة، وقد استخدمت لتحديد حموضات عدد من الحموض الضعيفة جداً. فأحد المركبات يكون حمضاً أقوى من مركب آخر إذا كان يستطيع إزاحة المركب الثاني من أملاحه.

دعونا ننظر نظرة أكثر قرباً إلى الحموضات النسبية للكحولات والماء. فالفرق بين الكحول والماء هو، طبعاً، الزمرة الالكيلية . وليس فقط الزمرة الالكيلية هي التي تجعل الكحول أقل حموضة من الماء، بل كلما كانت الزمرة الالكيلية اكبر كانت حموضة الكحولات اقل؟ فالميتانول هو الأقوى حموضة والكحولات الثالثية هي الأضعف حموضة. وقد اعتقد مدة طويلة ان هذا التأثير المضعف للحموضة في الكحولات هو تأثير قطبي : بالمنح الالكتروني لزمر الالكيل يقوي الشحنة السالبة لأيونات الألكوكسيد ويجعلها قواعداً أقوى. لكنه وجد انه في الطور الغازي تكون الحموضات النسبية للكحولات المختلفة والحموضات النسبية للكحولات والماء معكوسة ، ويبدو واضحاً هنا ان زمر الالكيل السهلة الاستقطاب تساعد على استيعاب الشحنة السالبة، تماماً كما تساعد على استيعاب الشحنة الموجبة في الكربوكاتيونات. وتكون الكحولات حموضاً أضعف من الماء في المحلول – حيث نكون مهتمين بالحموضة عادة – وهذا هو تأثير التذاوب ؛ فالزمرة الكبيرة تتداخل في التأثيرات المتبادلة، ثنائي قطب – أيون ، التي تثبت الانيون.
وبما ان الكحول حمض أضعف من الماء، فإن الالكوكسيد لا يحضر بتفاعل الكحول مع هيدروكسي الصوديوم، بل بتفاعل الكحول مع المعدن الفعال نفسه.
*اساس = قاعدة